
����Ŀ������������һ��ʱ��ͼ�����߱�ʾ��Ӧ2NO��g��+O2��g��2NO2��g����H��0��ƽ��ʱNO ��ת�������¶ȵĹ�ϵ��ͼ�ϱ���A,B,C,D,E�㣬�����й�˵����ȷ���ǣ� �� 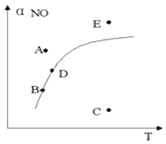
A.A�㷴Ӧδ�ﵽƽ��״̬���ҷ�Ӧ�����ƶ�
B.C��NOת������ͣ��һ�ѧ��Ӧ������С
C.B,D�����������Ӧ�¶��µĻ�ѧƽ��״̬���Ҧ�B��NO������D��NO��
D.E�㷴Ӧδ��ƽ�⣬��Ӧ�����ƶ���������ѹǿ����
���𰸡�C
���������⣺A��A��E��������Ӧ�¶��£����ߵ��Ϸ���NO��ת���ʸ�����Ӧ���¶�ƽ���NO��ת���ʣ���Ӧ���淴Ӧ���У���V����V�� �� ƽ�������ƶ�����A����
B��C������Ӧ�¶��£����ߵ��·���NO��ת����С����Ӧ�¶ȵ�ƽ���NO��ת���ʣ���Ӧ������Ӧ���У���V����V�� �� ƽ�������NOת���������¶�Խ�ͷ�Ӧ����ԽС������B��������С����B����
C����ͼ��֪��B��D���㴦�������ϣ�Ϊƽ��㣬����ƽ��״̬����V��=V�� �� �¶����ߣ�ƽ�������ƶ������Ԧ�B��NO������D��NO������C��ȷ��
D��E������Ӧ�¶��£����ߵ��Ϸ���NO��ת���ʸ�����Ӧ���¶�ƽ���NO��ת���ʣ���Ӧ���淴Ӧ���У���V����V�� �� ƽ�������ƶ�����D����
��ѡC��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л��������ᴿ������ȷ���� (����)
������ȡ�������廯�ƺ͵������ˮ��Һ�����ù��˷�����Fe(OH)3�����FeCl3��Һ�Ļ������ýᾧ���ᴿ����NaCl��KNO3
A.�٢ڢ�
B.�٢�
C.�ڢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�����ˮ��Ӧ�Ʊ���������ԭ�����۲����ʸߣ�����ʵ���ƹ��ֵ��
��֪����CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.2kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��42.3kJmol��1
��1�������ˮ�������ɶ�����̼���������Ȼ�ѧ����ʽ ��
��2��Ϊ��̽����Ӧ�����Է�ӦCO��g��+H2O��g��CO2��g��+H2��g����H=��42.3kJmol��1��Ӱ�죬ij�С�����������ʵ�飬ʵ��������ͼ��ʾ��
��� | �¶� | ѹǿ | cʼ��CO�� | cʼ��H2O�� |
�� | 530�� | 3MPa | 1.0molL��1 | 3.0molL��1 |
�� | X | Y | 1.0molL��1 | 3.0molL��1 |
�� | 630�� | 5MPa | 1.0molL��1 | 3.0molL��1 |
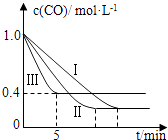
��������ʵ������ͼ�������������е�ʵ��������X=�棬Y=MPa��
��ʵ���ӿ�ʼ��ƽ�⣬��ƽ����Ӧ�ٶ���v ��CO��=molL��1min��1 ��
��ʵ����ƽ��ʱCO��ת����ʵ����ƽ��ʱCO��ת���ʣ�����ڡ�����С�ڡ����ڡ�����
����530��ʱ��ƽ�ⳣ��K=1������1L������Ͷ��0.2mol CO��g����0.2mol H2O��g����1mol CO2��g����0.1mol H2��g������ʱ��ѧ��Ӧ������������������淽������ �ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е�CaCl2��MgSO4����ɳ���ɽ���������ˮ��Ȼ���������5��������ٹ��ˣ��ڼӹ�����NaOH��Һ���ۼ���������ܼӹ���Na2CO3��Һ���ݼӹ�����BaCl2��Һ����ȷ�IJ���˳���ǣ���
A.�٢ܢڢݢ�
B.�ܢ٢ڢݢ�
C.�ڢܢݢ٢�
D.�ݢڢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�������ڱ��е����λ�����±��������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʡ������ж���ȷ����
A. �����ԣ���>��>�� B. ԭ�Ӱ뾶����>��>��
C. ������ԭ�Ӻ�����������11 D. �ҵĵ����ڿ�����ȼ������ֻ�����Ӽ��Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ǣ� ��
A.����ʪ��pH��ֽ��ϡ����Һ��pH���ⶨֵƫС
B.������ƿ������Һ������ʱ���ӿ̶��ߣ�������ҺŨ��ƫС
C.�ζ�ǰ�ζ����������ݣ��յ����ʱ�����ݣ��������ƫС
D.�ⶨ�кͷ�Ӧ�ķ�Ӧ��ʱ��������������У������¶�ֵƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��nmolO2��nmolCO��Ƚϣ�����˵������ȷ���ǣ� ��
A. ��ͬ��ͬѹ��������
B. ԭ�������
C. �ڱ�״�����������
D. ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڹ�ũҵ������Ӧ�ù㷺��
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ �� ���ֲ�ͬ�����ĵ��ӣ�
��2��BF3����ˮ����һ�������¿�ת��ΪH3O+[B��OH��F3]�� �� �������������ӵĿռ乹��Ϊ �� �����ӵ�����ԭ�ӹ�������ӻ���
��3����BH4����Ϊ�ȵ����ݵķ�������д��ѧʽ����
��4��EminBF4���۵�Ϊ12�棬�ڳ�����ΪҺ�壬���л���������[Emin]+��[BF4]�����ɣ������ʵľ����������壮
��5��һ��������̣�Sm���γɵľ���ľ����ṹ��ͼ��ʾ����֪��������a=n pm��������ܶ�Ϊgcm��3����NAΪ����٤��������ֵ���� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��Cu3P2��������������ͭ������ͭ�Ǻ�����������ͭ�Ͻ���Ҫ������ĥ����͵���ԭ����
��1����̬ͭԭ�ӵĵ����Ų�ʽΪ���۵����гɶԵ�����������
��2����ͭ��ˮ���ò����ж������⣨PH3���� ��PH3�����е�����ԭ�ӵ��ӻ���ʽ�� ��
��P��Nͬ���壬������������Ӧˮ��������ԣ�HNO3H3PO4����������������ӽṹ�ĽǶ�˵�����ɣ� ��
��3������ͭ�е���������Ԫ�ص縺�ԵĴ�СΪSnP���������������=������
��4��ij����ͭ�����ṹ��ͼ��ʾ�� 
�����仯ѧʽΪ ��
�ڸþ����о���Cuԭ�������Snԭ����������ЩSnԭ�������ֵĹ���Ϊ ��
���������ܶ�Ϊ8.82g/cm3 �� �����Cuԭ�Ӻ˼��Ϊpm���ú�NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com