
【题目】高铁酸盐是新型、高效、多功能的绿色水处理剂。
(1)配平化学方程式并标出电子转移方向和数目:
_____Fe(OH)3+ NaClO+ NaOH→ Na2FeO4+ NaCl+ H2O
反应中氧化剂是_____,被还原的元素是_____;
(2)若上述反应中转移0.3mol电子,则消耗NaOH的物质的量为_____;
(3)高铁酸钠和二氧化氯都是高效杀菌消毒剂,消毒效率(单位物质的量转移的电子数)高铁酸钠是二氧化氯的_____倍;
(4)含Fe3+的溶液与NaHCO3混合,产生红褐色沉淀,同时有无色无味的气体生成,用平衡移动原理解释上述现象_____;
(5)比较同温下浓度均为0.01mol/L的①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3四种溶液中c(CO32﹣)的大小关系为_____(用编号表示)。
【答案】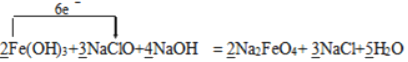 NaClO +1价的Cl 0.2mol 0.6 HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动 ②>③>④>①
NaClO +1价的Cl 0.2mol 0.6 HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动 ②>③>④>①
【解析】
根据反应可知铁元素的化合价从+3价升高到+6价,失去3个电子,氯元素的化合价从+1价降低到—1价,得到2个电子,则根据得失电子守恒可知氧化剂与还原剂的物质的量之比是3:2,再根据质量守恒定律可知反应的化学方程式可表示为2Fe(OH)3+ 3NaClO + 4NaOH=2 Na2FeO4 + 3 NaCl + 5H2O,据此回答。
⑴ 根据得失电子守恒和质量守恒定律可知反应的化学方程式可表示为2Fe(OH)3+ 3NaClO + 4NaOH=2 Na2FeO4 + 3 NaCl + 5H2O,氯元素的化合价降低,氯元素被还原,NaClO做氧化剂,故答案为: 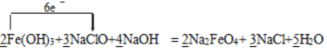 ;NaClO;+1价的Cl;
;NaClO;+1价的Cl;
⑵ 由分析可知,当转移6 mol电子时消耗4 mol NaOH,所以转移0.3mol电子时,消耗氢氧化钠物质的量为0.2mol,故答案为:0.2mol;
⑶ 化合价变化:Na2FeO4中Fe:+6 降到+3 ,变化为3,ClO2中 Cl:+4降到-1,变化为5,单位物质的量转移电子数之比为3:5=0.6倍,答案为:0.6;
⑷ 含Fe3+的溶液中存在Fe3+的水解平衡:Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+,加入NaHCO3,其中HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动,形成Fe(OH)3沉淀,故答案为:HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动;
Fe(OH)3 + 3H+,加入NaHCO3,其中HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动,形成Fe(OH)3沉淀,故答案为:HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动;
⑸要看其它离子对碳酸根离子的影响,②中存在大量CO32-,没有离子对碳酸根离子产生影响;③④对比,铵根离子水解促进HCO3-离子的水解,HCO3-的电离相对就弱了,所以③>④;碳酸的第二步电离才产生碳酸根离子,而碳酸的第二步电离很弱,CO32-极少,所以c(CO32﹣)的大小关系为②>③>④>①,故答案为:②>③>④>①。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】人在做剧烈运动后,有一段时间腿和胳膊会有酸胀和疼痛的感觉。原因之一是C6H12O6(葡萄糖)在运动过程中转化为C3H6O3(乳酸)。4.5g乳酸与足量的钠反应,在标准状况下得气体1120mL。9g乳酸与相同质量的甲醇反应,生成0.1mol乳酸甲酯和1.8g水。乳酸被氧化时得![]() 。则乳酸的结构简式是( )
。则乳酸的结构简式是( )
A. HOCH2CH2COOHB. HOCH2CH(OH)COOH
C. CH3OCH2COOHD. CH3CH(OH)COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法错误的是( )
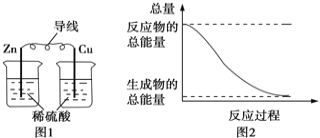
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为放热反应
C.中和反应中,生成物的总能量比反应物的总能量低
D.化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋氨酸片适用于脂肪肝以及酒精和磺胺等药物引起的肝损害。其组成蛋氨酸的合成线路如下:
![]()
![]()
![]()
![]() C
C![]()
![]()
![]()
![]()
![]()
说明:流程图中“Et”为乙基。
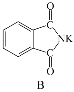
(1)C的结构简式为____________。
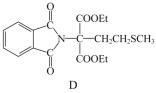
(2)D→E的反应类型为_________。
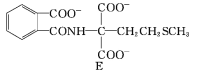
(3)由E合成F时生成了另一种有机物G,G的化学名称为___;由蛋氨酸合成多肽的化学方程式为________。
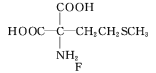
(4)H与G互为同分异构体。H能发生银镜反应,且苯环上的一氯代物只有1种,水解后的产物能与FeCl3溶液发生显色反应。写出满足上述条件的H的结构简式:_________。
(5)已知:①—NH2![]() —NHCHO
—NHCHO![]() —
—![]()
②—CN![]() —COOH以
—COOH以![]() 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物![]() 的流程如下:
的流程如下:
![]()
![]() A
A![]() B
B![]() C
C![]()
![]()
写出上述流程图方框中相应有机物的结构简式:A_________,C__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g)﹣236kJ
(1)反应涉及的元素原子半径从大到小的排列顺序为_____。其中硅原子最外层有_____个未成对电子,有_____种不同运动状态的电子;
(2)反应涉及的化合物中,写出属于非极性分子的结构式:_____;产物中晶体硅的熔点远高HCl,原因是_____;
(3)氯和硫是同一周期元素,写出一个能比较氯和硫非金属性强弱的化学方程式:_____;
(4)在一定温度下进行上述反应,若反应容器的容积为2L,3分钟后达到平衡,测得气体质量减小8.4g,则在3分钟内H2的平均反应速率为_____;
(5)该反应的平衡常数表达式K=_____,可以通过_____使K增大;
(6)一定条件下,在密闭恒容器中,能表示上述反应一定达到化学平衡状态的是_____。
a.v逆(SiCl4)=2v正(H2)
b.固体质量保持不变
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为:
 ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是
A. 分子式为![]() B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol
B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol![]() D. 与溴的
D. 与溴的![]() 溶液反应生成的产物经水解、稀硝酸化后可用
溶液反应生成的产物经水解、稀硝酸化后可用![]() 溶液检验
溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
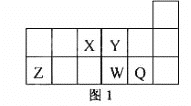
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括F、Cl、Br等元素。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是______。

(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为______,该功能陶瓷的化学式为______。
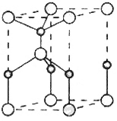
(3)BCl3和NCl3中心原子的杂化方式分别为__________和________。第一电离能介于B、N之间的第二周期元素有______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com