
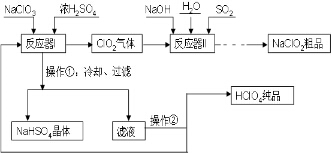
 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:分析 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程为:反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O,NaHSO4的溶解度随着温度的降低而减小,冷却得到NaHSO4晶体,滤液通过蒸馏得到HClO4产品,通入到反应容器Ⅱ中的反应物有NaOH、SO2、H2O、ClO2,生成物有NaClO2,反应的方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O,
(1)过滤操作的常用玻璃仪器有(普通)漏斗、玻璃棒、烧杯;
(2)反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2+3NaHSO4+H2O;温度太低,反应速率太慢,温度太高不利于NaHSO4结晶析出,而且会造成高氯酸的损失,因为高氯酸的沸点为90℃,所以温度应<90℃; 互溶的液体,可根据沸点的不同用蒸馏法分离;
(3)根据流程图可知:反应物有ClO2+SO2+NaOH、生成物有NaClO2,由ClO2变成ClO2-,化合价降低,则SO2应被氧化生成SO42-,然后根据守恒配平即可;
(4)根据影响化学反应速率的因素可知,加快反应器Ⅱ中反应速率的措施有:适当升高温度[增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等];从反应器Ⅱ中获得NaClO2晶体的实验操作依次是蒸发浓缩、冷却结晶、过滤;要除去NaClO2粗品中的少量可溶性杂质,进一步提纯的操作为重结晶.
解答 解:(1)过滤操作的常用玻璃仪器有(普通)漏斗、玻璃棒、烧杯,
故答案为:(普通)漏斗、玻璃棒、烧杯;
(2)温度太低,反应速率太慢,温度太高不利于NaHSO4结晶析出,而且会造成高氯酸的损失,因为高氯酸的沸点为90℃,所以温度应<90℃,应选C; 互溶的液体,可根据沸点的不同用蒸馏法分离蒸馏,
故答案为:C;蒸馏;
(3)根据流程图可知:反应物有ClO2+SO2+NaOH、生成物有NaClO2,由ClO2变成ClO2-,化合价降低,则SO2应被氧化生成SO42-,然后根据守恒配平即可;
故答案为:2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(4)根据影响化学反应速率的因素可知,加快反应器Ⅱ中反应速率的措施有:适当升高温度、增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等;从反应器Ⅱ中获得NaClO2晶体的实验操作依次是蒸发浓缩、冷却结晶、过滤;要除去NaClO2粗品中的少量可溶性杂质,进一步提纯的操作名称为重结晶,
故答案为:适当升高温度、增大NaOH溶液的浓度、增大气体(SO2、ClO2)和NaOH溶液的接触面积等;DF(A);B.
点评 本题是一道工艺流程题目,考查角度广,难度较大,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol | B. | 0.5 mol | C. | 0.6 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
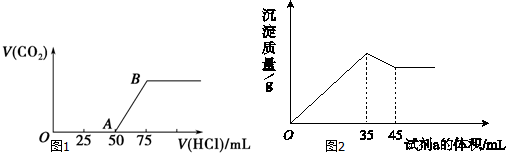
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
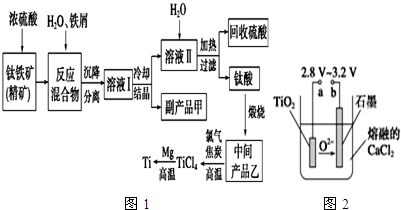
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、AlO2- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+.、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与稀盐酸反应:Cu+2H +═Cu2 ++H2↑ | |
| B. | 小苏打与氢氧化钠溶液混 合:HCO3 -+OH -═CO2↑+H2 O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2 ++CO3 2 -═CaCO3↓ | |
| D. | CuSO4 与Ba(OH)2 溶液混合Cu2 ++SO4 2 -+2OH -+Ba2+═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②④⑤ | C. | ①②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com