
| A. | XeF4 | B. | SF6 | C. | CCl4 | D. | BF3 |
分析 分子中元素原子最外层电子数与其化合价绝对值之和为8,则分子中该原子满足8电子结构,结合分子中各原子形成共价键判断.
解答 解:A.XeF4中Xe原子本身最外层电子数为8,与F原子形成化学键,最外层电子数大于8,故A不符合;
B.SF6中S原子本身最外层电子数为6,与F元素形成6对共用电子对,最外层电子数为12,故B不符合;
C.CCl4中C原子本身最外层电子数为4,化合价为+4,故4+4=8,碳原子满足8电子结构,Cl原子本身最外层电子数为7,化合价为-1,而7+|-1|=8,Cl原子满足8电子结构,故C符合;
D.BF3中B原子本身最外层电子数为3,与F元素形成3对共用电子对,最外层电子数为6,故D不符合;
故选C.
点评 本题考查共价键、8电子结构判断,注意共价化合物分子中:“原子最外层电子数与其化合价绝对值之和为8,则分子中该原子满足8电子结构”,若含有H原子,一定不符合分子中所有原子均满足8电子结构,


科目:高中化学 来源: 题型:选择题
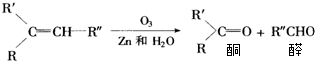
| A. |  | B. | 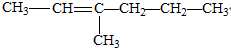 | ||
| C. | 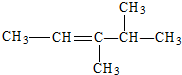 | D. | 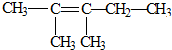 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 原子中核外电子排布的周期性变化是产生元素周期律的根本原因 | |
| D. | 核素就是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、溴水 | B. | NaOH溶液、溴水 | ||
| C. | 高锰酸钾溶液、溴水 | D. | NaHCO3溶液、溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
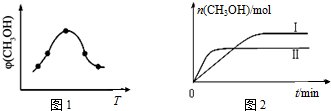
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
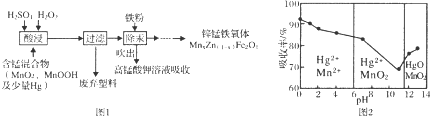
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com