
1998ÄźÄĻ·½·¢ÉśŗéĄŌŌÖŗ¦£¬ČŗÖŚŅūĖ®Ņ²³ÉĮĖ“óĪŹĢā£¬ŅņĪŖŗéĖ®ÓŠ¶ąÖÖ²”¾ś”£ĪŖ“ĖÓŠ¹Ų²æĆŵ÷¼Æ“óĮæĘÆ°×·ŪÓĆÓŚĖ®µÄ“¦Ąķ£¬ŌŚĻū¶¾Ź±£¬¼ÓŅ»µć¶ł“×£¬Ļū¶¾æģŠ§¹ūŗĆ£¬ÕāŹĒĪŖŹ²Ć“?
ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬¶ŌÓŚÄŃČܵē½āÖŹAmBn£¬ŌŚĖ®ÖŠæɽØĮ¢ČēĻĀĘ½ŗā£ŗ
AmBnƒmAn++nBm-
ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬µ±c(An+)m”Įc(Bm-)n=KspŹ±£¬ČÜŅŗ³Ź±„ŗĶדĢ¬£¬³ĮµķĮæ¼Č²»Ōö¼Ó£¬Ņ²²»¼õÉŁ£»µ±c(An+)m”Įc(Bm-)n>KspŹ±£¬ČÜŅŗ³Ź¹ż±„ŗĶדĢ¬£¬½«Īö³ö³Įµķ£»µ±c(An+)m”Įc(Bm-)<KspŹ±£¬ČÜŅŗ³Ź²»±„ŗĶדĢ¬£¬³Įµķ½«Čܽā”£
ŹŌøł¾ŻÉĻŹöŌĄķ£¬¼ĘĖć£ŗ
£Ø1£©ŅŃÖŖŌŚ³£ĪĀĻĀ£¬FeSµÄKsp=6.25´10-18£¬Ēó“ĖĪĀ¶ČĻĀFeSµÄČܽā¶Č(g/100gĖ®)”£(É豄ŗĶČÜŅŗµÄĆܶČĪŖ1g”ĮmL-1)
£Ø2£©ŅŃÖŖH2S±„ŗĶČÜŅŗŌŚ³£ĪĀĻĀ£¬c(H+)Óėc(S2-)¼ä“ęŌŚ×ÅŅŌĻĀ¹ŲĻµ£ŗc(H+)2”Įc(S2-)=1.0´10-22”£ŌŚøĆĪĀ¶ČĻĀ£¬½«ŹŹĮæFeSĶ¶ČėH2S±„ŗĶČÜŅŗÖŠ£¬ÓūŹ¹ČÜŅŗÖŠc(Fe2+)µ½“ļ1mol”ĮL-1£¬Ó¦µ÷½ŚČÜŅŗµÄpHĪŖ¶ąÉŁ?
ĘÆ°×·Ū¼ÓČėĖ®ÖŠŗó·“Ó¦£ŗCa(ClO)2+CO2+H2OØTØTCaCO3”ż+2HClO£¬ÓÉÓŚĖ®ÖŠCO2ÉŁ£¬ĖłŅŌ¼ÓČė“×£¬Ź¹ČÜŅŗÖŠH+Ōö¼Ó£¬ÓŠĄūÓŚÖĘČ”³öHClO£¬Ļū¶¾É±¾śæģ”£ £Ø1£©FeSČÜŅŗÖŠKsp=c(Fe2+)c(S2-)=6.25´10-18ÓÉÓŚČÜŅŗµÄc(FeS)=c(S2-)=c(Fe2+)£¬ĖłŅŌ c(FeS)= Ōņ100gĖ®ÖŠŗ¬FeS£ŗ £Ø2£©µ±c(Fe2+)=1mol”ĮL-1Ź±£¬c(S2-)=6.25´10-18mol”ĮL-1ÓÖc(H+)2”Įc(S2-)=1.0´10-22 ĖłŅŌc(H+)= pH=-lgc(H+)=-lg(4´10-3)»2.4
|


 ÓżӾ«¾ķĻµĮŠ“š°ø
ÓżӾ«¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| T/K | 303 | 313 | 323 |
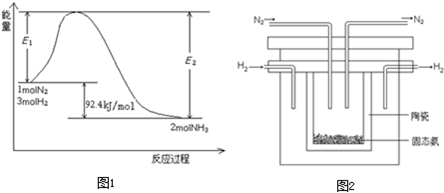
| NH3Éś³ÉĮæ/£Ø10-6mol£© | 4.8 | 5.9 | 6.0 |
| H | + 4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗĪļĄķ½ĢŃŠŹŅ ĢāŠĶ£ŗ038
ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬¶ŌÓŚÄŃČܵē½āÖŹAmBn£¬ŌŚĖ®ÖŠæɽØĮ¢ČēĻĀĘ½ŗā£ŗ
AmBnƒmAn++nBm-
ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬µ±c(An+)m”Įc(Bm-)n=KspŹ±£¬ČÜŅŗ³Ź±„ŗĶדĢ¬£¬³ĮµķĮæ¼Č²»Ōö¼Ó£¬Ņ²²»¼õÉŁ£»µ±c(An+)m”Įc(Bm-)n>KspŹ±£¬ČÜŅŗ³Ź¹ż±„ŗĶדĢ¬£¬½«Īö³ö³Įµķ£»µ±c(An+)m”Įc(Bm-)<KspŹ±£¬ČÜŅŗ³Ź²»±„ŗĶדĢ¬£¬³Įµķ½«Čܽā”£
ŹŌøł¾ŻÉĻŹöŌĄķ£¬¼ĘĖć£ŗ
£Ø1£©ŅŃÖŖŌŚ³£ĪĀĻĀ£¬FeSµÄKsp=6.25´10-18£¬Ēó“ĖĪĀ¶ČĻĀFeSµÄČܽā¶Č(g/100gĖ®)”£(É豄ŗĶČÜŅŗµÄĆܶČĪŖ1g”ĮmL-1)
£Ø2£©ŅŃÖŖH2S±„ŗĶČÜŅŗŌŚ³£ĪĀĻĀ£¬c(H+)Óėc(S2-)¼ä“ęŌŚ×ÅŅŌĻĀ¹ŲĻµ£ŗc(H+)2”Įc(S2-)=1.0´10-22”£ŌŚøĆĪĀ¶ČĻĀ£¬½«ŹŹĮæFeSĶ¶ČėH2S±„ŗĶČÜŅŗÖŠ£¬ÓūŹ¹ČÜŅŗÖŠc(Fe2+)µ½“ļ1mol”ĮL-1£¬Ó¦µ÷½ŚČÜŅŗµÄpHĪŖ¶ąÉŁ?
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com