
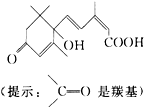
| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 含有苯环、羟基、羰基、羧基 | ||
| C. | 含有羟基、羰基、羧基、酯基 | D. | 含有碳碳双键、苯环、羟基、羰基 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
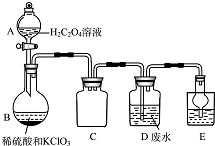 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液加入盐酸,有无色无味气体产生 | 溶液一定含有CO32- |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液一定含Fe2+ |
| C | 向某溶液滴加浓NaOH溶液加热,有能使湿润的红色石蕊试纸变蓝的气体产生 | 溶液一定存在NH4+ |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管中有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组 别 | 被选出的物质 | 挑选依据 |
| 第(1)组 | ||
| 第(2)组 | ||
| 第(3)组 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
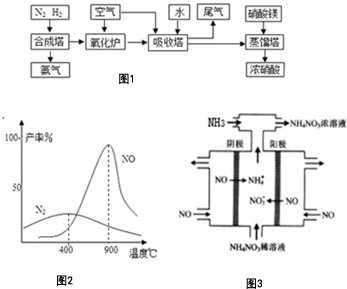 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com