
A、B、D、E、Z、G、M七种元素位于元素周期表前四周期,原子序数依次增大。元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物DE2为红棕色气体,Z的单质易与水反应且只作氧化剂,G是前四周期中第一电离能最小的元素,M是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题:
(1)元素B、D、E的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)基态G原子的价电子排布式是 ,M在元素周期表中的位置是 。
(3)元素D和Z组成分子NZ3空间构型为________;该分子为 分子(填极性或非极性),其中D原子的杂化方式为________。
(4)D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙常温下,若甲、乙两溶液的pH均等于5,则由水电离出的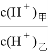 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为____________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是 ;
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________。
科目:高中化学 来源:2016-2017学年天津市高一上期末化学卷(解析版) 题型:实验题
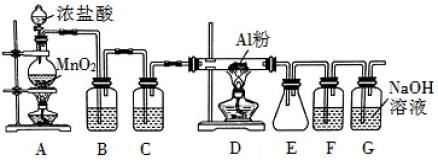
氯气在工业上有着重要的用途,某兴趣小组在实验室中用下列装置模拟工业上用氯气制备无水氯化铝(183℃时升华,遇潮湿空气即产生大量白雾)。
 请回答下列问题:
请回答下列问题:
(1)装置 B 中盛放饱和食盐水,其作用是 。F 中盛放的是 ,其作用是 。用一件仪器装填适当试剂后也可起到 F 和 G 的作用,所装填的试剂为 。
(2)装置 A 实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入 MnO2 粉末 B.加热 C.往烧瓶中加入浓盐酸
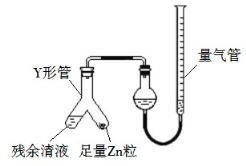
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学 提出很多实验方案,其中方案之一为让残留的液体与足量 Zn 反应,测量生成的 H2体积。 装置如图所示(夹持器具已略去)。反应完毕,每间隔 1 分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 ClO2 生成;ClO2 沸点为 10 ℃,熔点为?59 ℃,液体为红色;Cl2 沸点为?34 ℃,液态为黄绿色。设计最简单的实验验证 Cl2中含有 ClO2: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省等名校高二上期末化学卷(解析版) 题型:选择题
如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述不正确的是( )
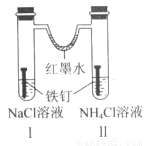
A.红墨水水柱两边的液面变为左低右高
B.I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+
C.I 中正极反应式为 O2+2H2O+4e-=4OH
D.Ⅱ中 NH4Cl 溶液里有气泡产生
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知
A. X的原子半径大于Y的原子半径
B. X的电负性大于Y的电负性
C. X的氧化性小于Y的氧化性
D. X的第一电离能小于Y的第一电离能
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
下列有关物质性质的比较,不正确的是
A. 金属性:Li>Na>K>Rb B. 酸性:HF<HCl<HBr<HI
C. 微粒半径:K+>Na+>Mg2+>Al3+ D. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
下列有关方程式书写正确的是( )
A.醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-=H2O
B.H2S在水溶液中的电离:H2S+H2O H3O++ HS-
H3O++ HS-
C.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4 (g)+2O2 (g) == CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+H+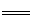 I2+ 2H2O
I2+ 2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省简阳市高二上学期期末化学试卷(解析版) 题型:选择题
如下图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3molA和1molB,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
A.③②① B.③①② C.①②③ D.②①③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:填空题
(1)按要求填写下列空格(设阿伏加德罗常数为NA)
①39 g Na2O2中的Na+_________ NA;
②0.5mol H2O中的质子数为_________NA;
③1.204×1024个水分子的质量为_________ g;
④标准状况下,10g CO和CO2混合气体的体积是6.72L,则此混合气体中,CO和CO2的物质的量之比是 ;
⑤9.2g氮的氧化物NOx中含有N原子数为0.2mol,则x数值为 。
(2)用于分离或提纯物质的方法有:
A蒸馏(分馏) B萃取 C过滤 D重结晶 E分液
分离或提纯下列各组混合物 ,请选择上述最合适的方法的标号填在橫线上。
,请选择上述最合适的方法的标号填在橫线上。
①除去Ca(OH)2溶液中悬浮的CaCO3微粒 ;
②分离四氯化碳与水的混合物 ;
③分离汽油和柴油 ;
④提纯氯化钠和硝酸钾混合溶液中的硝酸钾 。
(3)找出下列各组物质中与另三种物质的类别不同的一种物质,用化学式填写在后面的横线上。
① CaO、Na2O、CO2、CuO ;
② H2、N2、P、Cu ;
③ S、Fe、Cu、Zn ;
④ HCl、H2O、H2SO4、HNO3 。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:实验题
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
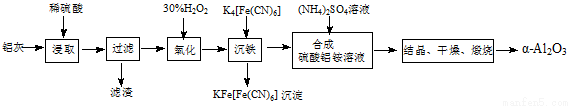
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O] 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
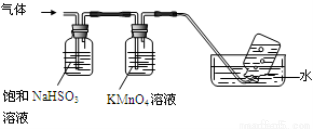
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com