
| A、液氨可用作制冷剂 |
| B、小苏打用于治疗胃酸过多 |
| C、明矾可用于自来水的杀菌消毒 |
| D、硅酸钠用于制备硅胶和木材防火剂的原料 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、在纯水中加入醋酸会促进水的电离 |
| B、1mL pH=2的醋酸稀释至10mL,pH=3 |
| C、常温下,0.1mol?L-1氯化铵溶液加水稀释,溶液中所有离子浓度均减小 |
| D、加热Na2CO3溶液能提高其除油污的能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入少量HCl气体,平衡向逆反应方向移动 |
| B、加水,反应速率加快,平衡向逆反应方向移动 |
| C、滴加少量0.1mol/L NaOH溶液,溶液中c(OH-)减少 |
| D、加入少量NH4Cl固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该装置实现化学能转变为电能 |
| B、该装置中Cu2+向Zn电极移动 |
| C、该装置外电路中电子由Zn棒转移到Cu棒 |
| D、该装置中Zn棒上的电极反应为:Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Br2水可鉴别苯与乙醇 |
| B、将混合气体通过灼热的铜网除去N2中的少量O2 |
| C、用KMnO4溶液除去乙烯中的乙炔 |
| D、用适量HNO3除去NaNO3溶液中少量的Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
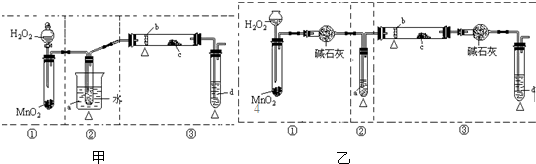
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(s)+H2(g) | K3 | ? | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com