
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平_________________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO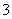 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式___________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式___________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O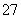 ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式___________。
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式___________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式________________________________________________________________________
________________________________________________________________________。
答案 (1)①2KMnO4+10KCl+8H2SO4===6K2SO4+2MnSO4+5Cl2↑+8H2O
②2Mn2++5NaBiO3+14H+===2MnO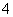 +5Na++5Bi3++7H2O
+5Na++5Bi3++7H2O
(2)Cr2O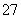 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
(3)2KMnO4+C2HCl3===2KCl+2CO2↑+2MnO2+HCl
解析 (1)①根据信息,KMnO4在H2SO4作用下,把KCl氧化成Cl2,本身被还原成Mn2+。②注意NaBiO3不能拆写成离子形式。NaBiO3作为氧化剂,把Mn2+氧化成MnO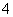 ,本身被还原成Bi3+。(3)根据信息,MnO
,本身被还原成Bi3+。(3)根据信息,MnO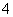 的还原产物为MnO2,C2HCl3中C被氧化为CO2,H、Cl的化合价不发生变化。
的还原产物为MnO2,C2HCl3中C被氧化为CO2,H、Cl的化合价不发生变化。
解题技巧


科目:高中化学 来源: 题型:
有关溶液中所含离子的检验,下列判断中正确的是( )
A.加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在
B.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO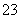 存在
存在
C.用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素
D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐酸盐溶液,只用NaOH溶液是不能一次鉴别开的
查看答案和解析>>
科目:高中化学 来源: 题型:
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G—→Q+NaCl
②Q+H2O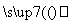 X+H2
X+H2
③Y+NaOH—→G+Q+H2O
④Z+NaOH—→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
在铜的冶炼过程中有如下反应发生
5FeS2+14CuSO4+12H2O===7Cu2S+5FeSO4+12H2SO4
关于此反应,下列说法正确的是( )
A.Cu2S既是氧化产物,又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.FeS2只作还原剂
D.产物中的SO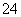 有一部分是氧化产物
有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO +Cu2S+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO +CuS+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+—→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是________(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②中电子转移的方向和数目:MnO +CuS
+CuS
Ⅱ.在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。由上述反应得出的物质氧化性强弱的结论是________>________(填写化学式)。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A.8.64 B.9.20
C.9.00 D.9.44
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是( )
A.2∶3 B.3∶2 C.4∶3 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A.Al3+、Cl-、AlO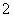 、SiO
、SiO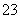
B.H+、Na+、S2-、ClO-
C.K+、Mg2+、SO 、MnO
、MnO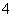
D.Fe3+、Ca2+、SCN-、NO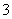
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com