
80℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的碳酸中:c(H+)=3.0molL-1
B.饱和乙酸钠溶液中:c(Na+)= c(CH3COO-)
C.pH为2的盐酸中:c(H+)=c(Cl﹣)+c(OH﹣)
D.pH=13的烧碱溶液中:c(OH-)=1.0×10-1molL-1
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(16分)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
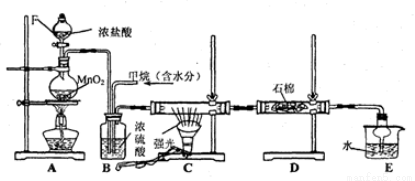
根据要求填空:
(1)装置A中反应的化学方程式为 ,当产生336mL气体(标准状况)时,有 mol还原剂被氧化。
(2)B装置有三种功能:①控制气流速度;②_______;③________________。
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是______。
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是_______________________。
(5)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_______________________________。
(7)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为_______。该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是__________(填编号)。
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
下列反应,属于加成反应的是
A.CH4+Cl2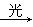 CH3Cl+HCl
CH3Cl+HCl
B.C6H6+Br2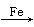 C6H5Br+HBr
C6H5Br+HBr
C.CH2==CH2+Br2―→CH2Br—CH2Br
D.CH3COOH+CH3CH2OH 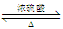 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三普通高考测试(二)理综化学试卷(解析版) 题型:简答题
液氨是一种良好的储氢物质。
已知:① 2NH3(g)  N2 (g) + 3H2(g) ΔH = +92.4 kJ·mol-1
N2 (g) + 3H2(g) ΔH = +92.4 kJ·mol-1
② 液氨中2NH3(l)  NH2- + NH4+
NH2- + NH4+
(1)氨气自发分解的反应条件是 (填“低温”或“高温”)。
(2)图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。反应的活化能最大 的是 (填催化剂的化学式)。
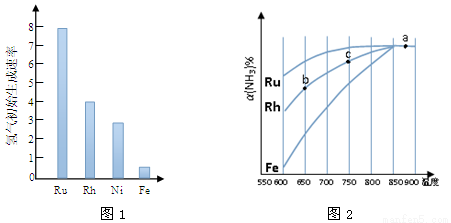
(3)其他条件相同,反应①在不同催化剂作用下反应相同时间后,氨气的转化率随反应温度的变化如图2所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点氨气的转化率高于b点,原因是 。
③请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线。
④假设Ru催化下,温度为750℃时,氨气的初始浓度为c0,平衡转化率为40%,则该温度下此反应的 平衡常数K = 。
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:实验题
(16分)氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是______________________________________________________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
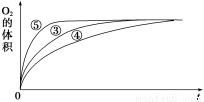
分析该图能够得出的实验结论是_________________________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
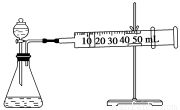
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。
请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
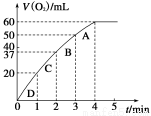
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):
a. ;b. 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | H2O2、SO2都能使酸性高锰酸钾溶液褪色 | 前者表现出还原性后者表现出漂白性 |
B | 纯银器表面在空气中渐渐变暗 | 发生化学腐蚀 |
C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:推断题
【化学—选修5有机化学基础】石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图:
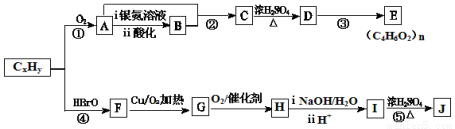
已知:Ⅰ.下列反应中R、R′代表烃基
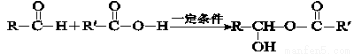
Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是____。
(2)H的分子式是 。
(3)下列说法正确的是 。
a.CxHy和苯都能使溴水褪色,原理相同
b.反应②和反应④的反应类型均为加成反应
c.C能与Na、NaOH、NaHCO3反应
d.E是一种水溶性很好的高分子化合物
e.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出两种符合条件K的结构简式____。
(5)写出反应⑤的化学方程式______________。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
某种药物合成中间体的结构简式为: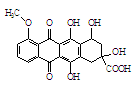 ,有关该物质的说法不正确的是
,有关该物质的说法不正确的是
A.属于芳香族化合物
B.能发生消去反应和酯化反应
C.能分别与金属Na、NaHCO3溶液反应
D.1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com