
| A. | 直接往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032- | |
| B. | 取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42- | |
| C. | 取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明原溶液中含Cl-. | |
| D. | 取少量溶液加入HCl酸化后滴加BaCL2溶液产生白色沉淀,证明原溶液中含SO42- |
分析 A、C032-、HC032-、S032-、HS032-遇到稀H2S04后都会产生大量气泡;
B、含有SO42-、SO32-的溶液加入Ba(NO3)2溶液后都能产生白色沉淀;
C、能和银离子之间反应生成白色沉淀氯化银的是氯离子,盐酸能提供氯离子;
D、硫酸根离子和钡离子之间反应得到白色的沉淀硫酸钡,该沉淀不会溶于盐酸.
解答 解:A、往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032-、HC032-、S032-、HS032-中至少一种,故A错误;
B、取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42-、SO32-的至少一种,故B错误;
C、取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明溶液中含有氯离子,但是盐酸能提供氯离子,氯离子不一定来自原溶液,故C错误;
D、取少量溶液加入HCl酸化后滴加BaCl2溶液产生白色沉淀,排除碳酸根、亚硫酸根离子的干扰,证明原溶液中含SO42-,故D正确.
故选D.
点评 本题考查了常见离子的检验,侧重学生的分析、实验能力的考查,注意把握物质的性质以及离子方程式的书写,难度不大.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
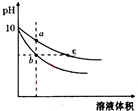 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)=$\frac{1000b+c(H+)V}{V}$ mol/L | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol/L | |
| C. | 溶质的质量分数w=$\frac{a}{ρV-a}$×100% | |
| D. | 向上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇在电池的负极放电生成CO2时,共失去12mol 电子 | |
| B. | 1mol/L碳酸钠溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1mol | |
| C. | 25℃时,1L pH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| D. | 电解精炼铜,当电路中转移NA个电子,阳极溶解的铜<32g,阴极析出铜32g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=-2 878 kJ•mol-1 | B. | △H=-2 658 kJ•mol-1 | ||
| C. | △H=-1 746 kJ•mol-1 | D. | △H=-1 526 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X的反应速率为0.2 mol•L-1•s-1,则Z的反应速率为0.3 mol•L-1•s-1 | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com