
已知反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③I2+SO2+2H2O=H2SO4+2HI,判断下列物质的还原能力由强到弱的顺序是
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
下列有关说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B.镀锡铁制品镀层受损后,铁制品比受损前更容易生锈
C.N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2 )和H2的平衡转化率均增大
D.常温下,某溶液的PH=2,则该溶液一定是酸溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
可逆反应①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
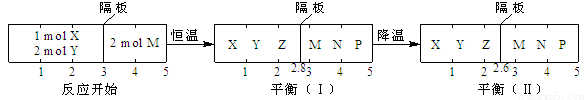
下列判断正确的是:
A 反应①的正反应是吸热反应
B 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C 达平衡(I)时,X的转化率为5/11
D 在平衡(I)和平衡(II)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷(解析版) 题型:选择题
将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
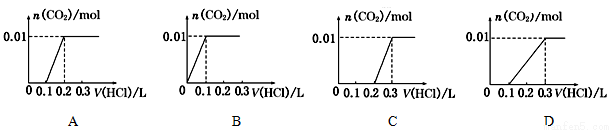
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷(解析版) 题型:选择题
下列离子方程式正确的是
A.稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3
B.硫酸与氢氧化钡反应:H++SO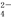 +Ba2++OH-==BaSO4↓+H2O
+Ba2++OH-==BaSO4↓+H2O
C.氧化铜与稀硫酸反应:2H++O2-==H2O
D.碳酸钠溶液中加入盐酸:CO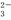 +2H+==CO2↑+H2O
+2H+==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷(解析版) 题型:选择题
现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,可鉴别且鉴别的先后顺序也正确的是
A.④③②①⑤ B.④⑤③②① C.④③①②⑤ D.④②③①⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高一上期中化学卷(解析版) 题型:实验题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-。将该混合物溶于水后得澄清溶液,现取3份 100 mL该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体0.896L(换算成标准状况) |
3 | 加入足量BaCl2溶液,,将 | 第一次称重读数为6.27g,第二次称重读数为2.33g |
已知加热时NH4++OH-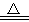 NH3↑+H2O,回答下列问题:
NH3↑+H2O,回答下列问题:
(1)判断混合物中Cl-是否一定存在 _。(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高一上期中化学卷(解析版) 题型:选择题
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是
A.Na+、Ag+、CO32-、Cl- B.K+、 Ba2+、 SO42-、Cl-
C.Na+、K+、CO32-、Cl- D.Na+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高二上期中化学卷(解析版) 题型:实验题
I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入润洗过的锥形瓶中,并加入1或2滴酚酞溶液
⑤滴入一滴标准液后,溶液颜色由无色变为红色立即停止滴定,记录液面读数
请回答:
(1)以上步骤有错误的是(填编号) 。
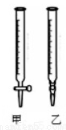
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_________中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:_________(填编号)
A.酸式滴定管未润洗
B.滴定前,滴定管尖嘴无气泡,滴定后有气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.滴定结束时仰视滴定管,并记录数据
E.滴定过程中有一滴标准液飞溅出锥形瓶
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼 睛注视 。
睛注视 。
II.利用中和滴定的原理,在工业生产中还可以进行氧化还原滴定测定物质含量。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉状TiO2。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(5)除去TiCl4含有的杂质A3+可选用调节pH的方法使其转化为A(OH)3沉淀除去。已知Al(OH)3的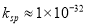 ,若想将Al3+完全沉淀(不考虑钛离子的沉淀),则溶液的pH一定不能小于__________。(
,若想将Al3+完全沉淀(不考虑钛离子的沉淀),则溶液的pH一定不能小于__________。( 时,即可认为完全沉淀)
时,即可认为完全沉淀)
(6)TiCl4水解生成TiO2·xH2O的化学方程式为__________________________。
(7)滴定终点的现象是___________________________。
(8)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com