
【题目】某回学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)
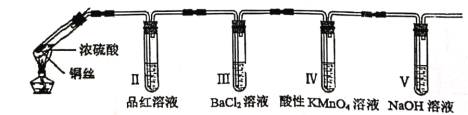
下列说法错误的是
A. 反应后,试管Ⅰ中出现白色固体,将其放入水中,溶液显蓝色
B. 试管Ⅱ中品红溶液逐渐褪色,对其加热溶液又恢复红色
C. 试管Ⅳ中高锰酸钾褪色,体现了SO2的漂白性
D. 试管Ⅴ可以改为装有碱石灰的干燥管
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】写出以下反应的化学方程式:
(1)Na2O2与水反应:____________。
(2)Al2O3溶于NaOH溶液:______________。
(3)将FeCl3饱和溶液滴入沸水中制备氢氧化铁胶体:____________。
(4)向Al2(SO4)3溶液中滴加氨水制备氢氧化铝:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑该反应中还原剂是________________。(填化学式)
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:_____________。
②每生成2mol FeO42-转移________mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和1 mol FeBr2的溶液中通入2.5 mol Cl2,此时依次被氧化的离子是__________,被氧化的离子对应的物质的量之比是________________。
(2)若向含a mol FeI2和b mol FeBr2的混合溶液中通入c mol Cl2,当该混合溶液与通入的Cl2恰好完全反应时,a、b、c的关系为______________________(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表,下列说法不正确的是
M(g)+N(s),所得实验数据如下表,下列说法不正确的是
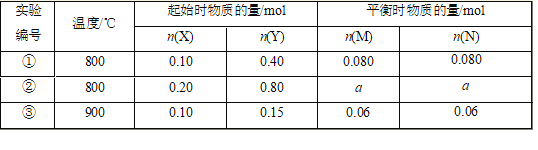
A. 正反应为放热反应
B. 实验①中,5min达平衡,用X表示的平均反应速率v(X)=0.016 mol/(L·min)
C. 实验②中,该反应的平衡常数K=12.5
D. 实验②中,达到平衡时,a大于0.16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度下等物浓度的下列溶液中,A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
① pH值由大到小的顺序是___________________(用对应的字母填写)。
② NH4+离子浓度由大到小的顺序是___________________(用对应的字母填写)。
(2)25℃向50 mL 0.018 mol·L-1 的 AgNO3溶液中加入50 mL 0.020 mol·L-l的盐酸,生成沉淀。己知该温度下AgCl的Ksp =l.0×l0-10,忽略溶液的体积变化,请计算:
① 完全沉淀后,溶液中c(Ag+)=_____________。
② 完全沉淀后,溶液的pH=____________。
(3)弱酸及其盐在水中存在多种平衡关系。己知NaA水溶液呈碱性,常温下将0.l mol NaA和0.05 mol HCl溶于水,得到1 L溶液。
① 己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为___________________。
② 向该混合物中再加0.03mol NaOH,溶液中n(A-) +n(OH-)-n(H+) =________。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5 mol·L-1 Fe3+和0.26 mol·L-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+) ≤ 4×l0-5 mol·L-1 ]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2 = 2.6×l0-19;KspFe(OH)3 = 4×l0-38]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究橄榄石(仅含三种短周期元素)的组成和性质。
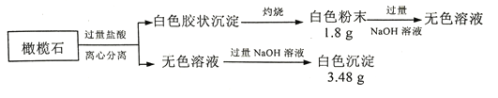
(1)橄榄石的组成元素是O和____、____(填元素符号),化学式为__________。
(2)写出白色粉末A的一种用途:__________________________。
(3)白色粉末A溶于NaOH溶液的离子方程式是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
![]()
![]() +H2O
+H2O

可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是__________.
(2)加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________________.
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是_______________.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号).
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. υ(A)=0.5mol/(L·s) B. υ(B)=0.3mol/(L· s) C. υ(C)=0.8mol/(L·s) D. υ(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
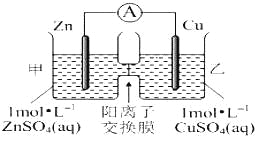
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com