
(16分)硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于滴定实验某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质
已知:Na2SO3 + S = Na2S2O3
I.制备 Na2S2O3
(1)如图,组装好仪器,检验完气密性(气密性良好),各装置试剂均装入后的下一步操作是______
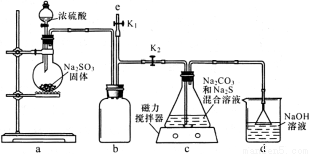
(2)反应开始后,C中发生了多个化学反应写出其中任意一个非氧化还原反应的方程式_____________
(3)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1 ,其目的是______待c中溶液冷却后,倒入蒸发皿,通过加热蒸发冷却结晶和干燥等操作获得Na2S2O3·5H2O晶体
Ⅱ.探究Na2S2O3的部分化学性质
【提出假设】
假设一:Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7
假设二:从S元素的化合价推测Na2S2O3具有较强的还原性
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空)
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
假设一 | ___________________ | 溶液pH=8 | ________________________ |
假设二 | 向溴水中滴入适量Na2S2O3溶液 | 溴水褪色 | ___________________________ |
【实验结论】__________________
Ⅲ:用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32-=2I-+S4O62-)
根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3︰4。下列说法中正确的是
A.原子半径:W>Z>Y>X
B.氢化物稳定性:Y>Z
C.WY3中只有离子键没有共价键
D.X与Z可形成l0电子分子和18电子分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下图为常温下用0.10mol·L-1NaOH溶液滴定20.00 mL 0.10 mol·L-1盐酸和20.00 mL 0.10 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是
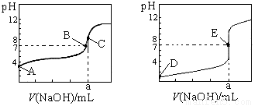
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+)= c(A—)
C.B点时,反应消耗溶液体积:V(NaOH)>V(HA)
D.当0mL<V(NaOH)<20. 00mL时,溶液中一定是c(A-)>c(Na+)>c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:推断题
聚酯增塑剂G及某医药中间体H的一种合成路线如下(部分反应条件略去):
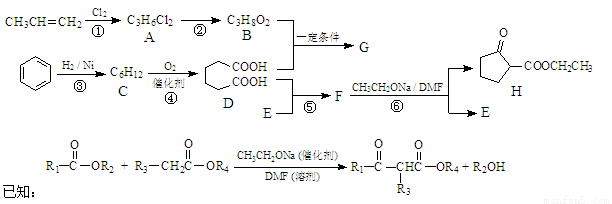
(1)B的名称(系统命名): ,D的分子式为 。
(2)反应①~⑥中属于取代反应的是 。
(3)G的结构简式为 。
(4)写出反应②和⑥的化学方程式:② ,⑥ 。
(5)C存在多种同分异构体,写出核磁共振氢谱只有两种峰的同分异构体的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列有关FeBr2溶液的叙述错误的是
A.滴加KI-淀粉溶液变为蓝色
B.该溶液中Cu2+、NH4+、SO42-、Cl- 可以大量共存
C.与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体
D.向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2==2Fe3++2Br2+6Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KHCO3溶液中:Ca2+ Al3+ Cl—C2O42-
B.水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+Ba2+Cl-I-
C.1.0 mol·L-1 KI溶液中:H+Fe3+SCN-SO42-
D.pH=13的溶液中:NH4+Na+NO3-SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:实验题
(本题共12分)某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:

已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
1.写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
2.加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
3.实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
4.测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是 。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
5.根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
6.按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
液态氨中可电离出极少量的NH2-和NH4+。下列说法正确的是
A.NH3属于离子化合物 B.常温下,液氨的电离平衡常数为10-14
C.液态氨与氨水的组成相同 D.液氨中的微粒含相同的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com