
分析 (1)化学反应是放热反应,升温,平衡逆向进行,平衡常数减小;
(2)化学平衡的标志是正逆反应速率相同,各组分含量保持不变,“变量不变”据此分析;
解答 解:(1)2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1,反应是放热反应,升温平衡逆向进行,平衡常数减小,所以该反应450℃时的平衡常数大于该反应500℃时的平衡常数,
故答案为:>;
(2)化学平衡的标志是正逆反应速率相同,各组分含量保持不变;
A.速率之比等于化学方程式计量数之比,当2v(O2)正=v(SO3)逆,说明三氧化硫正逆反应速率相同,但选项中速率之比错误,故A不符合;
B.反应前后气体质量不变,但反应前后物质的量在变,则平均相对分子质量在反应过程中一直在变,所以容器中气体的平均相对分子质量不再变能说明反应达到平衡状态,故B符合;
C.反应前后气体质量不变,容器体积不变,密度在反应过程中和平衡状态都不变,容器中混合气体的密度保持不变不能说明费用达到平衡状态,故C不符合;
D.反应前后物质的量在变,则容器中气体的分子总数在反应过程中一直在变,所以容器中气体的分子总数不再变能说明反应达到平衡状态,故D符合;
故答案为:BD,
点评 本题考查了化学平衡平衡常数及其平衡状态的判断,掌握化学平衡的标志是正逆反应速率相同,各组分含量保持不变是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
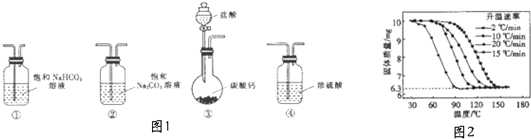
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
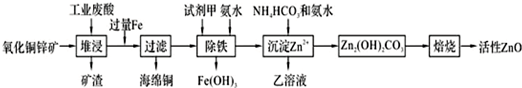
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com