
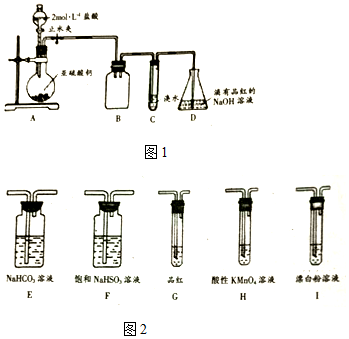
| ѡ�� | ʵ����������� | ʵ����� |
| A | ��ij��Һ�м��������ữ���Ȼ�����Һ���а�ɫ�������� | ����Һ��һ������SO42- |
| B | ��Fe��NO3��2��Ʒ����ϡH2SO4���μ�KSCN��Һ��Һ��� | Fe��NO3��2��Ʒ���������� |
| C | ��ʢ������NaHCO3���Թ��еμӲ�����Һ�����ݲ��� | ���ԣ����̼�� |
| D | ������ij���ʵ�ϡ��Һ�еμ�ϡ���ᣬ��������ʹ����ʯ��ˮ����ǵ����� | ������һ����̼���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A����ɫ����ΪAgCl�����ᱵ��
B��Fe��NO3��2��Ʒ����ϡH2SO4������������ԭ��Ӧ���������ӣ�
C������ǿ����ȡ����ķ�Ӧ��
D����ʹ����ʯ��ˮ����ǵ�����Ϊ������̼���������
��� �⣺A����ɫ����ΪAgCl�����ᱵ����ԭ��Һ�п��ܺ������ӻ���������ӣ������߲���ͬʱ���ڣ���A����
B��Fe��NO3��2��Ʒ����ϡH2SO4������������ԭ��Ӧ���������ӣ����ű��ʵļ��飬Ӧ����ˮ����B����
C������ǿ����ȡ����ķ�Ӧ������Ϊ������̼�������ԣ����̼�ᣬ��C��ȷ��
D����ʹ����ʯ��ˮ����ǵ�����Ϊ������̼���������������ʲ�һ����̼���Σ���D����
��ѡC��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�������ʵ����ʡ����Ӽ��顢��Ӧԭ����ʵ�鼼��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��ʵ��Ľ�ϣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��� | T/K | ����ʯ��� | HNO3Ũ�� |
| �� | 298 | �ֿ��� | 2.00 mol•L-1 |
| �� | 298 | �ֿ��� | 1.00 mol•L-1 |
| �� | 308 | �ֿ��� | 2.00 mol•L-1 |
| �� | 298 | ϸ���� | 2.00 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����� | �� | �� | �� | �� | �� |
| ����������g�� | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba��OH��2��Һ�����mL�� | 300 | 300 | 300 | 300 | 300 |
| ���ɳ�����������g�� | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϡ���������Ƭ�ϣ�2Fe+6H+�T2Fe3++3H2�� | |
| B�� | ����ͭ��Һ������������Һ��ϣ�CuSO4+2OH-�TCu��OH��2+SO42-������þ��ϡ�����ϣ�MgO+2H+�TMg2++H2O | |
| C�� | ���������Ȼ�����Һ��Ӧ��AgNO3+Cl-�TAgCl��+NO3- | |
| D�� | ̼��������Һ��ϡ������Һ��ϣ�HCO3-+H+=H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1��l | B�� | 2��2��1 | C�� | 1��1��2 | D�� | 4��3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������� | ��ѧʽ | ��Է������� | ��ɫ | �ܽ��� |
| ���������������� | K3[Fe��C2O4��3]•3H2O | 491 | ����ɫ | ������ˮ���������Ҵ� |
| �������� | FeC2O4•2H2O | 180 | ��ɫ | ������ˮ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2mol������1mol���������������ԼΪ2��1 | |
| B�� | 2mol������1mol��������������ԼΪ1��1 | |
| C�� | 1mol������3mol��������������ԼΪ1��3 | |
| D�� | 1mol������3mol����������ܶȱ�ԼΪ1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
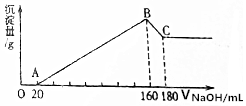 ��һ��������þ�����Ͻ�Ͷ��200mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣬��������Һ�еμ�5mol/L NaOH��Һ�����ɵij������������NaOH��Һ�����ͼ��ʾ��
��һ��������þ�����Ͻ�Ͷ��200mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣬��������Һ�еμ�5mol/L NaOH��Һ�����ɵij������������NaOH��Һ�����ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com