
【题目】下列说法正确的是(NA为阿伏加德罗常数) ( )
A. 124 g P4中含有P—P键的个数为4NA
B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA
D. 60 g SiO2中含有Si—O键的个数为2NA
【答案】B
【解析】试题A、每个分子中含有6个P-P键,n(P4)=![]() =1mol,则124g P4含有P-P键的个数为6NA,故A错误;B、石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×
=1mol,则124g P4含有P-P键的个数为6NA,故A错误;B、石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×![]() =1.5个,则12g石墨含C原子的物质的量为1mol,则C-C键的个数为1.5NA,故B正确;C、金刚石中每个C都与令外4个C相连,则平均每个C原子成键数目为4×
=1.5个,则12g石墨含C原子的物质的量为1mol,则C-C键的个数为1.5NA,故B正确;C、金刚石中每个C都与令外4个C相连,则平均每个C原子成键数目为4×![]() =2个,12g金刚石中含C原子的物质的量为1mol,则含有C-C键的个数为2NA,故C错误;D、SiO2中每个Si原子与4个O原子成键,60g SiO2的物质的量为1mol,含Si-O键的个数为4NA,故D错误;故选B。
=2个,12g金刚石中含C原子的物质的量为1mol,则含有C-C键的个数为2NA,故C错误;D、SiO2中每个Si原子与4个O原子成键,60g SiO2的物质的量为1mol,含Si-O键的个数为4NA,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___。
(2)在第③步操作中,选择的除杂剂NaOH不能用KOH代替,理由是___。
(3)第④步中加入过量的Na2CO3的目的是___。
(4)在第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、___(填化学式)。
(5)写出第⑥步操作反应的离子方程式:___、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1
(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。
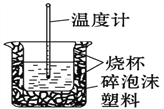
请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 20 L 的密闭容器中按物质的量之比 1∶2 充入 CO 和 H2,发生:CO(g)+2H2(g)CH3OH(g) ΔH。测得 CO 的转化率随温度的变化及不同压强下的变化,p2 和 195 ℃时 n(H2)随时间的变化结果如图表所示。下列说法正确的是( )

A. 0~3 min,平均速率 v(CH3OH)=0.8 mol·L-1·min-1
B. p1<p2,ΔH>0
C. 在 B 点时,v 正>v 逆
D. 在 p2 及 195 ℃时,该反应的平衡常数为 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2KClO3 + H2C2O4 + H2SO4= K2SO4 + 2ClO2 + 2CO2 + 2H2O。
(1)用单线桥法表示该反应的电子转移的方向和数目_______。
(2)该反应的氧化剂是____,还原剂是_____,氧化产物是_____,还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com