
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________。
(3)爆炸残留在废水中的CN-可以用Cr2O![]() 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
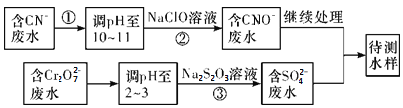
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________;
③步骤③中,每处理0.4 mol Cr2O![]() 时转移电子2.4 mol,该反应的离子方程式_________;
时转移电子2.4 mol,该反应的离子方程式_________;
【答案】 CN-+H2O===HCN↑+OH- NaCN+H2O2+H2O===NaHCO3+NH3↑ d CN-+ClO-===CNO-+Cl- 3S2O32-+4 Cr2O72-+26H+===6 SO42-+8Cr3++13H2O
【解析】(1)氰化钠遇水产生氰化氢气体的离子方程式为CN-+H2O===HCN↑+OH-。
(2)氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,N元素的化合价没有发生变化,则C的化合价升高、双氧水中O的化合价降低,再结合NaCN的组成分析,生成的白色晶体为NaHCO3,使得氰化钠的毒性大大降低,则氰化钠与双氧水反应的化学方程式为NaCN+H2O2+H2O===NaHCO3+NH3↑。
(3)①由流程可知,CN-经Cr2O![]() 处理后变为CNO-,所以上述处理废水流程中主要使用的方法是氧化还原法,选d。②反应②中后无气体放出,则ClO-被还原为Cl-,该反应的离子方程式为CN-+ClO-===CNO-+Cl-;③步骤③中,每处理0.4 mol Cr2O
处理后变为CNO-,所以上述处理废水流程中主要使用的方法是氧化还原法,选d。②反应②中后无气体放出,则ClO-被还原为Cl-,该反应的离子方程式为CN-+ClO-===CNO-+Cl-;③步骤③中,每处理0.4 mol Cr2O![]() 时转移电子2.4 mol,则处理1 mol Cr2O
时转移电子2.4 mol,则处理1 mol Cr2O![]() 时转移电子6 mol,所以Cr2O
时转移电子6 mol,所以Cr2O![]() 被还原为Cr3+,该反应的离子方程式为3S2O32-+4 Cr2O72-+26H+===6 SO42-+8Cr3++13H2O 。
被还原为Cr3+,该反应的离子方程式为3S2O32-+4 Cr2O72-+26H+===6 SO42-+8Cr3++13H2O 。


科目:高中化学 来源: 题型:
【题目】锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性。下列关于锂的判断可能正确的是
A.Li能在空气中燃烧B.Li2O熔点较低
C.Li2CO3能溶于水D.LiOH受热时不易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体和MgCl2溶液性质叙述正确的是
A. 均能够产生丁达尔效应 B. 微粒直径均在1~100 nm之间
C. 分散质微粒均可透过滤纸 D. 加入少量NaOH 溶液,只有MgCl2溶液产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下有:a.盐酸 b.硫酸 c.醋酸三种酸溶液.(用序号abc填空)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是__________.
②当其pH相同时,物质的量浓度由大到小的顺序为_________.将其稀释10倍后,pH由大到小的顺序为_____________
(2)某温度下,纯水中的c (H+)= 4.0×10-7 mol/L, 则此温度下纯水中的c (OH-)=______________mol/L; 若温度不变, 滴入稀NaOH溶液, 使c (OH-)= 5.0×10-6 mol/L,则溶液的c (H+)= _________________mol/L.
(3)在25℃时,100ml 1.0mol/L的盐酸与等体积1.2mol/L的氢氧化钠溶液混合, 混合后溶液的pH= _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。
(2)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是__________________________;配制完毕后要加入少量铁屑,其目的是__________________________。把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是___________,AlCl3溶液呈酸性的原因是(用离子方程式说明)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铵分解反应中,生成的含氮产物中仅有氮气和硝酸两种,其中被氧化的氮元素和被还原的氮元素物质的量之比为( )
A. 5:3 B. 1:1 C. 5:4 D. 3:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在一定条件下可以转化的是( )
A.CaCl2 ![]() CaCO3
CaCO3 ![]() CaO
CaO
B.Fe ![]() FeCl2
FeCl2 ![]() Fe(OH)2
Fe(OH)2
C.Al2O3 ![]() NaAlO2
NaAlO2 ![]() Al(OH)3
Al(OH)3
D.SiO2 ![]() H2SiO3
H2SiO3 ![]() Na2SiO3
Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为
A. (3.5 , 5.0) B. (3.5 , 7.1)
C. (5.0 , 7.1) D. ( 4.0 , 7.1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是
、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。25 ℃时,各组分含量随pH变化情况如图所示(Cl-没有画出)。下列说法错误的是

A. 25 ℃时,HClO2的电离平衡常数的数值Ka=10-6
B. 使用该漂白剂的最佳pH为3.0
C. 25 ℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO![]() )+2c(OH-)
)+2c(OH-)
D. 该温度下的NaClO2溶液中c(Na+)>c(ClO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com