
【题目】H2O2是一种常见试剂,在实验室、工业生产上有广泛用途
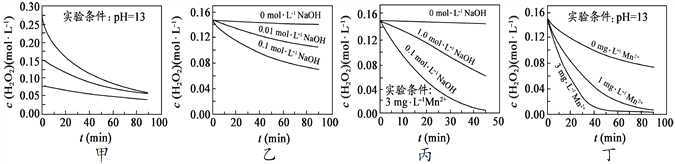
Ⅰ.实验室用H2O2快速制氧,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲乙丙丁四图所示:
(1)下列说法正确的是:________(填字母序号)
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
(2)催化剂Mn2+在反应中,改变了____________________(填字母序号)
A.反应速率 B.反应限度C.反应焓变 D.反应路径
E.反应活化能 F.活化分子百分数
Ⅱ. H2O2在工业上作为Fenton法主要试剂,常用于处理含难降解有机物的工业废水。在调节好pH(溶液的酸碱性)和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
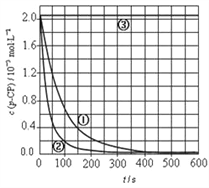
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验,并将实验结果绘制时间-p-CP浓度图如下。
(3)电中性的羟基自由基的电子式为:______________
(4)请完成以下实验设计表(表中不要留空格)。
实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | _________ | ______ | _______ | _________ |
③ | __________________ | 298 | 10 | 6.0 | 0.30 |
(5)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=_____________
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据实验结果,给出一种迅速停止反应的方法:__________________________。
【答案】 A D A D E F ![]() 313 3 6.0 0.30 探究溶液的酸碱性(pH)对降解反应速率的影响 8×10 - 6mol /(L·s) 加入NaOH溶液使溶液的pH=10(大于10也对)
313 3 6.0 0.30 探究溶液的酸碱性(pH)对降解反应速率的影响 8×10 - 6mol /(L·s) 加入NaOH溶液使溶液的pH=10(大于10也对)
【解析】试题分析:(1)根据图示分析;(2)催化剂通过改变反应路径降低活化能,提高反应速率,加入催化剂平衡不移动;(3)电中性的羟基含有9个电子;(4)探究温度对降解反应速率的影响,变量只能是温度;根据表格数据,实验③与实验①相比只有PH不同;(5)根据![]() 计算反应速率;(6)根据表格数据,pH=10时,反应速率几乎为0;
计算反应速率;(6)根据表格数据,pH=10时,反应速率几乎为0;
解析:(1) 由甲图可知,双氧水浓度越大,分解越快,H2O2浓度越小,其分解速率越慢,A正确;由图乙可知,溶液的碱性越强即pH越大,双氧水分解越快,B错误;C.溶液的碱性越强即pH越大,双氧水分解越快,故C错误;由图丙和图丁可知, Mn2+浓度越大,双氧水分解越快,D正确。
(2)催化剂通过改变反应路径降低活化能,提高反应速率,加入催化剂平衡不移动;催化剂能加快反应速率,故A正确;催化剂不能使平衡发生移动,故B错误;加入催化剂,平衡不移动,反应焓变不变,故C错误;催化剂参与反应,改变反应路径,故D正确;
催化剂降低反应活化能,故E正确; 催化剂通过降低活化能,提高活化分子百分数,故F正确。(3)电中性的羟基含有9个电子,电子式是![]() ;(4)探究温度对降解反应速率的影响,变量只能是温度,所以实验②与实验①只有温度不同,其余都相同,实验②温度是313K,PH=3,过氧化氢的浓度是6.0,Fe2+的浓度是0.30;根据表格数据实验③与实验①相比只有PH不同,实验③探究溶液的酸碱性对降解反应速率的影响;(5)根据
;(4)探究温度对降解反应速率的影响,变量只能是温度,所以实验②与实验①只有温度不同,其余都相同,实验②温度是313K,PH=3,过氧化氢的浓度是6.0,Fe2+的浓度是0.30;根据表格数据实验③与实验①相比只有PH不同,实验③探究溶液的酸碱性对降解反应速率的影响;(5)根据![]() ,v(p-CP)=
,v(p-CP)= ![]() = 8×10 - 6mol/(L·s);
= 8×10 - 6mol/(L·s);
(6)根据表格数据,pH=10时,反应速率几乎为0,加入NaOH溶液使溶液的pH=10,可以迅速停止反应;


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,可以加快反应速率的是( )
A. 锌与稀硫酸反应时,加入少量CuSO4固体
B. 钠与水反应时,增加水的量
C. 用18mol/L的硫酸溶液代替2mol/L硫酸溶液常温下与铝反应
D. 锌与稀硫酸反应时,加入少量醋酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g/mL。
(1)该溶液中NaOH的物质的量浓度为。
(2)该溶液中NaOH的质量分数为。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为 , 含NaOH的质量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫COS的结构与CO2相似,广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g) ![]() H2S(g)+ CO(g) △H=+7 kJ/mol
H2S(g)+ CO(g) △H=+7 kJ/mol
②水解反应: COS(g)+H2O(g) ![]() H2S(g)+ CO2(g) △H = ?
H2S(g)+ CO2(g) △H = ?
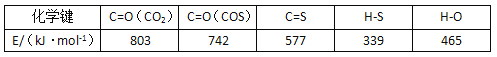
已知反应中相关的化学键键能数据如下:
回答下列问题:
(1)羰基硫的结构式为:___________,
(2)已知热化学方程式CO(g)+H2O(g) ![]() H2(g)+ CO2(g) △H3 则△H3 =__________kJ/mol。
H2(g)+ CO2(g) △H3 则△H3 =__________kJ/mol。
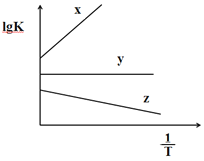
(3)COS的氢解反应的平衡常数K与温度T具有如下的关系式 ![]() ,式中a和b均为常数。
,式中a和b均为常数。
①如图中,表示COS氢解反应的直线为__________;
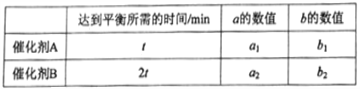
②一定条件下,催化剂A和B对COS的氢解反应均具有催化作用,相关数据如表所示:
则a1____a2 (填“>”或“<”或“=”)。
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=_________。(关于V的表达式)
(1)COS完全燃烧会生成大气污染物SO2。目前,科学家正在研究一种以乙烯作为还原剂的脱硫(SO2)方法,其脱硫机理如图2,脱硫率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3。
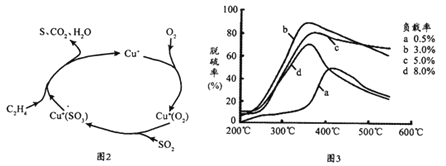
①该脱硫原理总反应的化学方程式为_________________________________________;
②据图3,为达到最佳脱硫效果,应采取的具体反应条件是________________________;
③根据a曲线在450℃以上的变化趋势,分析可能的原因是:______________________。
(5)为测定某工厂烟道气中SO2的含量,现将16.00 L烟道气缓慢通过1.00 L水,设SO2完全被吸收,且溶液体积不变。取出20.00 mL溶液,用1.18×10-3mol·L-1的饱和碘水与之反应,若恰好完全反应时消耗碘水19.07 mL,则该厂烟道气中SO2的含量为________________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高铁酸钠(Na2FeO4)处理河流湖泊的水用于饮用,是一项较新的技术,与此有关的以下叙述中,正确的是
①高铁酸钠溶液有强酸性 ②高铁酸钠有强氧化性
③高铁酸钠可使水软化 ④该过程中水被消毒和净化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
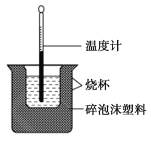
(1)该图中有两处未画出,它们是______________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)把温度为15.0 ℃,浓度为0.5 mol·L-1的酸溶液和0.55 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.4 | ΔH1 |
HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①试计算上述两组实验测出的中和热ΔH1=______,ΔH2=________。
②两组实验结果差异的原因是______________________________________。
③写出HCl+NH3·H2O的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关生活中的醋酸,其中主要利用了醋酸酸性的是( )。
①醋酸不小心滴到大理石桌面上,桌面失去光泽 ②熏醋可一定程度上防止流行性感冒 ③醋可以除去水壶上的水垢 ④用醋烹饪鱼,除去鱼的腥味
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com