
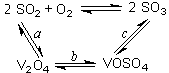
 SO3+ V2O4
SO3+ V2O4 2V2O5+4SO3��
2V2O5+4SO3�� 2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
 2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����
2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����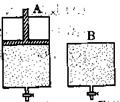
 2SO3
2SO3

 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д� �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CrO42-��2H+����K2Cr2O7����ˮ���ϡ��Һ�dz�ɫ��
2CrO42-��2H+����K2Cr2O7����ˮ���ϡ��Һ�dz�ɫ��| ʵ���� | NaOH��Һ��Ũ�� ��mol/L�� | �ζ����ʱ��NaOH��Һ����������mL�� | ����������Һ����� ��mL�� |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g��һ��ʱ���ﵽƽ�⣬����n mol C��������˵���в���ȷ���ǣ� ��
2C��g��һ��ʱ���ﵽƽ�⣬����n mol C��������˵���в���ȷ���ǣ� ��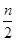 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g) ��H=��QkJ/mol���мס��������ݻ���ͬ�Ҳ�����ܱ���������������м���1 mol A��3 mol B����һ�������´ﵽƽ��ʱ�ų�����ΪQ1kJ������ͬ�������£����������м���2 mol C�ﵽƽ�����������ΪQ2 kJ����֪Q1=3Q2��������������ȷ���ǣ� ��
2C(g) ��H=��QkJ/mol���мס��������ݻ���ͬ�Ҳ�����ܱ���������������м���1 mol A��3 mol B����һ�������´ﵽƽ��ʱ�ų�����ΪQ1kJ������ͬ�������£����������м���2 mol C�ﵽƽ�����������ΪQ2 kJ����֪Q1=3Q2��������������ȷ���ǣ� �� A��g��+3B��g�� ��H= ��Q2 kJ/mol
A��g��+3B��g�� ��H= ��Q2 kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A�����������ܶȲ��ٱ仯 |
| B������������ɫ��dz |
| C�����������NO2��NO��O2�����ʵ���֮��Ϊ2:2:1 |
| D����λʱ��������2n mol NOͬʱ����2n mol NO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A��CO��HbO2��Ӧ��ƽ�ⳣ��K�� |
| B�����������COԽ�࣬��Ѫ�쵰��ϵ�O2Խ�� |
| C���������CO��O2Ũ��֮�ȴ��ڻ����0.02ʱ���˵������Ż����� |
| D����CO�ж��IJ��˷����ѹ�����нⶾ����ԭ����ʹ����ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cC(g)+dD(g)��C�İٷֺ���(C%)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�����и÷�Ӧ�Ħ�H�ͦ�S�ж���ȷ����(����)
cC(g)+dD(g)��C�İٷֺ���(C%)���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ�����и÷�Ӧ�Ħ�H�ͦ�S�ж���ȷ����(����)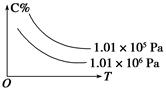
| A����H<0����S>0 | B����H>0����S<0 |
| C����H>0����S>0 | D����H<0����S<0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)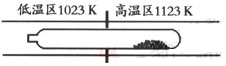
| A���ڲ�ͬ�¶�����TaI4 �������ֲ��� |
| B�����ᴿ�����У�I2 �������ϼ��� |
| C�����ᴿ�����У�I2 �������ǽ�TaS2 �Ӹ�����ת�Ƶ������� |
| D���÷�Ӧ��ƽ�ⳣ����TaI4 ��S2 ��Ũ�ȳ˻��ɷ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com