
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
电离能 | I1 | I2 | I3 | I4 | I5 |
电离能/(kJ·mol-1) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为________________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________。
(3)PO43-的中心原子的杂化方式为________,该离子的空间构型为________,键角为________,其等电子体有________(请写出两种)。
(4)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为________,原因为__________________。
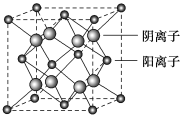
(5)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm-3(不必化简)。
【答案】+2 [Ar]4s2或1s22s22p63s23p64s2 F>O>P sp3 正四面体形 109°28′ SO42-、CCl4等 MgO>CaO Mg2+半径比Ca2+小,晶格能较大 12 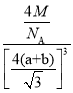
【解析】
(1)根据元素M的气态原子的第I1至I5电离能大小可以看出:I1、I2相差不大,I2、I3电离能相差较多,说明M原子最外层有2个电子。在Ca5(PO4)3中元素有Ca、P、O三种元素,只有钙元素最外层有2个电子,原子半径大,容易失去最外层的2个电子,化合价为+2价;根据原子核外电子排布规律可知Ca基态原子电子排布式为[Ar]4s2或1s22s22p63s23p64s2。
(2)Ca3(PO4)3F中非金属元素为F、O、P,三者的非金属性F>O>P,电负性与非金属性强弱关系一致,所以电负性由大到小的顺序为F>O>P;
(3)PO43-的中心原子P的价层电子对数是4,故磷原子杂化为sp3杂化;由于孤对电子对数为0,该离子的空间构型为正四面体形,键角为109°28′,原子数和价电子数分别都相等的是等电子体,其等电子体有SO42-、CCl4。答案为:sp3;正四面体形;109°28′;SO42-、CCl4等;
(4)已知MgO与CaO的晶体结构相似,Mg2+与Ca2+带电荷相同,但半径Mg2+比Ca2+小,晶格能大,所以其摩氏硬度的大小关系为MgO>CaO,原因为Mg2+半径比Ca2+小,晶格能较大。答案为:MgO>CaO;Mg2+半径比Ca2+小,晶格能较大;
(5)根据CaF2晶胞结构可知:在每个晶胞中与Ca2+距离最近且等距离的Ca2+有3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算了2次,所以与Ca2+距离最近且等距离的Ca2+有(3×8)÷2=12个;在CaF2晶胞中,共含有4个“CaF2”,将CaF2晶胞分成8个小正方体,正方体中心为F-,顶点为Ca2+,晶胞中共有4个钙离子、8个氟离子。Ca2+与F-的最近核间距(a+b)为晶胞体对角线的![]() 。故晶胞边长为
。故晶胞边长为![]() 。根据
。根据![]() =4M,可求晶体密度
=4M,可求晶体密度![]() =
=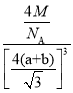 g·cm-3。答案为:12;
g·cm-3。答案为:12;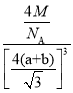 。
。


科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△//=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△=2×(-57.3)kJ/mol
B.需要加热才能发生的反应一定是吸热反应
C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mo1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
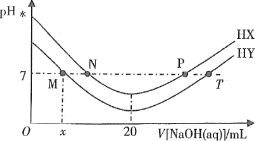
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
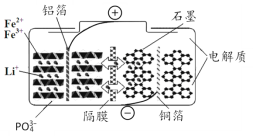
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是
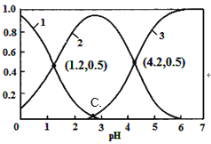
A.根据图中数据计算可得C点溶液pH为2.7
B.向草酸溶液中滴加氢氧化钠溶液至pH为4.2时c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
C.0.1 mol·L-1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HC2O4-)> c(C2 O42-) >c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,![]() 与
与![]() 可发生反应:
可发生反应:![]() 下列关于R元素的叙述中,正确的是( )
下列关于R元素的叙述中,正确的是( )
A.R位于周期表中![]() 族B.R的气态氢化物的水溶液是强酸
族B.R的气态氢化物的水溶液是强酸
C.![]() 中的R只能被还原D.
中的R只能被还原D.![]() 在常温常压下一定是气体
在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯中![]() 键的键能是乙烷中
键的键能是乙烷中![]() 键的键能的2倍
键的键能的2倍
B.氧气分子中含有1个![]() 键和1个
键和1个![]() 键
键
C.![]() 键的极性比
键的极性比![]() 键的极性大
键的极性大
D.![]() 中4个
中4个![]() 键的键能不相等
键的键能不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙二胺(![]() )是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与
)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。。乙二胺能与![]() 、
、![]() 等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“
等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的![]() 的结构式为__________,其中
的结构式为__________,其中![]() 的配位数为__________。
的配位数为__________。
(3)![]() 和
和![]() 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对![]() 与
与![]() 反应产物的推断正确的是__________(填序号)。
反应产物的推断正确的是__________(填序号)。
a 不能与![]() 反应
反应
b 含离子键、共价键
c 能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com