
【题目】下列化学用语不正确的是( )
A. 质子数为8、中子数为10的氧原子:![]()
B. 比例模型![]() , 不能表示二氧化碳,可以表示水分子
, 不能表示二氧化碳,可以表示水分子
C. 碳正离子(CH3+)的电子式为 ![]()
D. 氨气溶于水使溶液呈碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-
NH4+ + OH-
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为__________________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
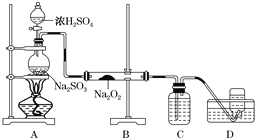
①盛放浓H2SO4仪器名称为____________。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为__________________、Na2O2+SO2===Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油;②溶解FeSO4配成溶液;③把蒸馏水加热煮沸,并密封冷却;④加入少量铁屑;⑤向FeSO4溶液中滴加足量氨水;⑥把盛有氨水的胶头滴管伸入FeSO4溶液中后再挤出氨水。进行操作的正确顺序是
A.③②⑤④B.③②④①⑥C.③②④⑥D.②④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学电化学知识,回答有关问题。
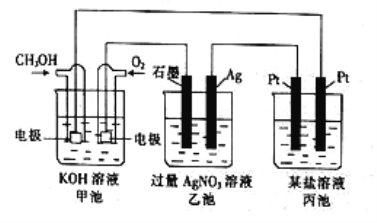
(1)图中甲池是____(填“原电池”或“电解池”)装置,其中OH-移向___(填“正”或“负”)极。
(2)通入CH3OH一端的电极反应式为_____________________。
(3)反应一段时间后,甲池中消耗560mL(标准状况)O2,此时乙池溶液的pH=______(设此时乙池中溶液的体积为100mL)。
(4)当乙池中Ag电极的质量增加5.4g时,丙池中某电极析出1.6g某金属,则丙池中的某盐可能是__________(填字母)。
A.MgSO4 B.CuCl2 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律分析下面的推断,其中错误的是( )。
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At)为白色固体,HAt不稳定,AgAt感光性很强
C. 硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒化氢(H2Se)无色、有毒,比H2S更不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所构成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是
A. 1.8 g 18O2的物质的量是0.05 mol
B. 0.1 mol H218O中所含的中子数约为6.02×1023
C. 0.2 mol 18O2的体积约为4.48 L
D. 18O2的摩尔质量为36 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

回答下列问题:
(1)步骤①所得废渣的成分是_____________(写化学式),操作II的名称是________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层)
2RAn(有机层)+nH2SO4(水层)
③中X试剂为_____________(写化学式)。
(3)按要求完成下列方程式
④的离子方程式为_________________________________________。
加氨水调节pH过程中涉及的离子方程式为: _________________、_______________。
(4)25时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
在实际生产中,⑤中加入氨水,调节溶液的最佳pH为________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_________mol/L(已知:25时,Ksp[Fe(OH)3]=2.610-39)。
(5)该工艺流程中,可以循环利用的物质有___________和_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为阳离子交换膜法以石墨为电极电解饱和食盐水原理示意图。据图判断下列说法不正确的是( )
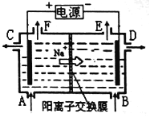
A.标准状况下,生成22.4LCl2的同时有2molNaOH生成
B.从C口流出的是NaOH溶液
C.从E口逸出的气体是H2
D.从F口逸出的气体是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对某绿矾样品进行了如下探究,请回答下列有关问题:
(1)在试管中加入少量该绿矾样品,加水溶解,分别滴加稀硫酸和KSCN溶液,溶液颜色无明显变化,由此得出的结论是_______。若向试管中继续通入空气,观察到溶液逐渐变红,说明溶液中的Fe2+转化为______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

① 仪器B的名称是_________;B中可加入下列试剂中的_______。(填标号)
a.Al2O3 b.Ca(OH)2 c.CuSO4 d.NaCl
②打开K1和K2,缓缓通入N2,点燃酒精灯,加热,接下来的实验操作步骤正确排序是______(填标号)。
a.熄灭酒精灯 b.关闭K1和K2 c.称量A d.冷却到室温
③重复上述操作步骤,直至A恒重,记为m3 g。此时,A中发生的化学反应方程式为___________;计算绿矾化学式中结晶水数目x=____(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com