
中和热的测定
B.0.50 mol·L-1盐酸,0.55 mol·L-1 NaOH溶液,100 mL量筒2个
C.0.50 mol·L-1盐酸,0.55 mol·L-1 NaOH溶液,50 mL量筒1个
D.0.50 mol·L-1盐酸,0.55 mol·L-1 NaOH溶液,50 mL量筒2个
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:阅读理解
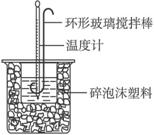
 实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
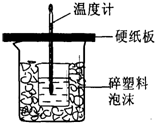
 实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:
实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
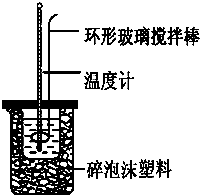
科目:高中化学 来源:2011-2012年呼伦贝尔市牙克石林业一中高一下学期期末考试化学试卷(带解析) 题型:实验题
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题: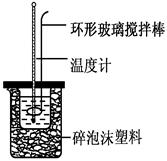
(1) 不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)如用0.50 mol·L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”)
(3)实验得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年呼伦贝尔市高一下学期期末考试化学试卷(解析版) 题型:实验题
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:

(1) 不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________。
(2)如用0.50 mol·L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”)
(3)实验得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
经数据处理,t2-t1=3.4℃。则该实验测得的中和热 ΔH =________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com