
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是()
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是()
A. V1>V2>V3 B. V1<V2<V3 C. V1=V2>V3 D. V1=V2<V3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是()
A. 热化学方程式各物质前的化学计量数不表示分子个数只代表物质的量
B. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
C. 同一化学反应,化学计量数不同,△H不同,化学计量数相同而状态不同,△H也不相同
D. 化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
查看答案和解析>>
科目:高中化学 来源: 题型:
由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4 Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
Ti已知:①C(s)+O2(g)=CO2(g);△H=﹣393.5kJ•mol﹣1②2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ•mol﹣1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ•mol﹣1,则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
若在铜片上镀银时,下列叙述正确的是()
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜片上发生的反应是:Ag++e﹣→Ag
④在银片上发生的反应是:4OH﹣﹣4e﹣→O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液.
A. ①③⑥ B. ②③⑥ C. ①④⑤ D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极减少的Cu的质量为m g,则()
A. 电解液质量增加m g B. 阴极质量增加a g,a>m
C. 阴极质量增加m g D. 阴极质量增加b g,b<m
查看答案和解析>>
科目:高中化学 来源: 题型:
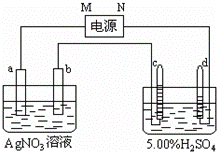
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.回答:
(1)直流电源中,M为 极.
(2)Pt电极上生成的物质是银,其质量为 g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2: : :1.
(4)AgNO3溶液的浓度(填增大、减小或不变.下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH .
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com