
| A. | 乙酸钾 | B. | 甲醇 | C. | 乙醇 | D. | 乙酸 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
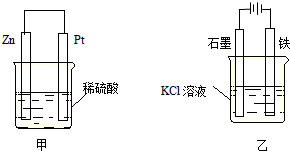
| A. | 该装置能形成原电池,其中锌是负极 | |
| B. | 该装置能形成原电池,其中铜是负极 | |
| C. | 该装置不能形成原电池 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4H中 H+的核外电子排布与He相同 | |
| B. | NH4H溶于水,所形成的溶液显碱性 | |
| C. | NH4H固体投入少量的水中,有两种气体产生 | |
| D. | NH4H与水反应时,NH4H是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4;C5H8 | B. | C3H8;C5H12 | ||
| C. | CH3-CH2-CH2-CH3 ; | D. | C2H5Cl;C3H6Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试管编号 | 3% Na2S2O3溶液 | H2O | 稀H2SO4(体积比为1:5) | 出现浑浊时间 |
| ① | 3mL | 3mL | 5滴 | 33s |
| ② | 4mL | 2mL | 5滴 | 28s |
| ③ | 5mL | 1mL | 5滴 | cs |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
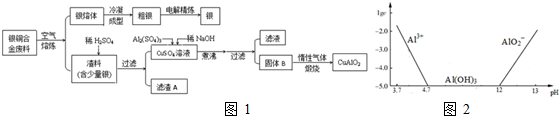
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
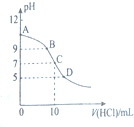 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mLamol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | B、D两点溶液中水电离出来的c(OH-):B<0 | |
| D. | C点溶液中的H2O不发生电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com