
【题目】几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )
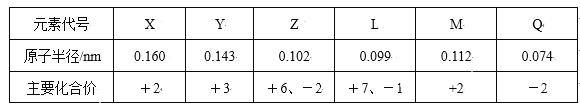
A. 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B. Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C. Z的氢化物的稳定性强于L的氢化物的稳定性
D. 与稀盐酸反应的剧烈程度:M单质<X单质
【答案】D
【解析】
短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X、M均有+2价,处于ⅡA族,原子半径X>M,则X为Mg元素、M为Be;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素,结合元素周期律及物质的结构与性质解答。
A.X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;
B.Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;
C. 非金属性Cl>S,所以稳定性HCl>H2S,即L的氢化物的稳定性强于Z的氢化物的稳定性,故C错误;
D. 金属性Mg>Be,故Mg与盐酸反应更剧烈,故D正确,
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于卤族元素的叙述中,正确的是( )
A. 随着原子序数的增加,元素的非金属性逐渐增强
B. 随着原子序数的减小,单质的氧化性逐渐增强
C. 通常呈黄绿色的也是氧化性最强的
D. 易升华的也是相对分子质量最大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 苯酚与碳酸钠溶液的反应![]()
B. 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2++2HCO3﹣+2OH﹣→CaCO3↓+CO32﹣+2H2O
C. 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++H++H2O2→Fe3++2H2O
D. 淀粉碘化钾溶液在空气中变蓝2I﹣+O2+2H2O→I2+4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是________;
(2)既发生离子键破坏、又发生共价键破坏的是______________;
(3)N2的电子式为________;Na2O2的电子式为________;
(4)用电子式表示MgCl2的形成过程 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,正确的是 ( )
A.新制氯水中只含Cl2和H2O分子B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2D.氯水放置数天后pH值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. 明矾易熔于水,可用作净水剂
B. 浓H2SO4具有脱水性,可用来千燥HC1
C. 碳酸钠具有碱性,可用于胃酸中和剂
D. 氧化镁熔点很高,可用于耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
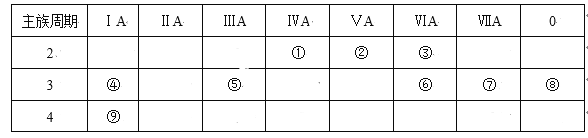
(1)在这些元素中,化学性质最不活泼的是:_____(填具体化学用语,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是:_____。
(3)最高价氧化物是两性氧化物的元素是___;写出它的氧化物与氢氧化钠反应的离子方程式__。
(4)②氢化物与③的单质在一定条件下反应的化学方程式为:______。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因________。
(6)用结构式表示元素①与③形成的化合物____,该化合物在固体时俗称___,属于____晶体,指出它的一种用途___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com