
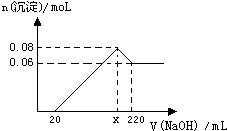
 现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:| 0.02mol |
| 1moL?L-1 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
| A、1mol食盐含有6.02×1023个分子 |
| B、Mg的摩尔质量为24 |
| C、1mol水中含有2mol氢和1mol氧 |
| D、1molNe含有6.02×1024个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L |
| B、从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
| C、配制500 mL 0.2 mol/L的CuSO4溶液,需称量CuSO4固体的质量为16.0g |
| D、中和100 mL 1 mol/L的H2SO4溶液,需NaOH的质量为4.0g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
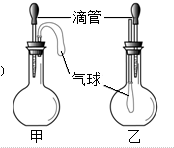
| A、甲:NaOH溶液和CO2,乙:H2O2和MnO2 |
| B、甲:CaCl2和Na2CO3溶液,乙:NaOH溶液和Cl2 |
| C、甲:浓硫酸和铝片.乙:浓氨水和SO2 |
| D、甲:浓硫酸和蔗糖.乙:水和氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )
反应mX(g)?nY(g)+pZ(g)△H,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示.下列说法错误的是( )| A、该反应的△H>O |
| B、m<n+p |
| C、B、C两点化学平衡常数:KB>KC |
| D、A、C两点的反应速率v(A)<v(C) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com