
| 选项 | 实验过程 | 现象 | 解释或结论 |
| A | 向浑浊的苯酚溶液中加入Na2CO3饱和溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| B | 向稀苯酚溶液中加入少量稀溴水 | 未见白色沉淀 | 苯酚不与溴反应 |
| C | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 证明:乙醇具有还原性 |
| D | 将乙醇和3mol•L-1的硫酸按体积之比1:3混合共热至170℃,产生的气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙醇发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯酚与碳酸钠溶液反应生成苯酚钠和碳酸氢钠,只能说明苯酚的酸性大于碳酸氢根离子;
B.苯酚必须与浓溴水反应,与稀的溴水不反应;
C.重铬酸钾能够氧化乙醇,证明乙醇具有还原性;
D.3mol•L-1的硫酸不是浓硫酸,该反应不会发生.
解答 解:A.向浑浊的苯酚溶液中加入Na2CO3饱和溶液,二者反应生成苯酚和碳酸氢钠,只能证明苯酚的酸性大于碳酸氢根离子,实际上苯酚的酸性小于碳酸,故A错误;
B.向稀苯酚溶液中加入少量稀溴水,二者不发生反应,则不会看到白色沉淀,该实验不能证明苯酚不与溴反应,故B错误;
C.乙醇与重铬酸钾(K2Cr2O7)溶液混合,橙色溶液变为绿色,证明重铬酸钾与乙醇反应生成了铬离子,在反应中乙醇被氧化,从而说明乙醇具有还原性,故C正确;
D.将乙醇和3mol•L-1的硫酸按体积之比1:3混合共热至170℃,由于硫酸浓度减小,不是浓硫酸,该反应不会发生,高锰酸钾溶液褪色是因为挥发的乙醇别氧化导致,故D错误;
故选C.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,明确常见元素及其化合物性质为解答关键,注意掌握实验方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.004 5mol•L-1? | <100个•mL-1? |
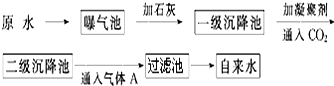
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
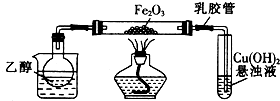
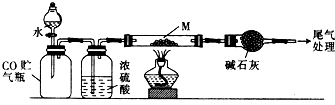
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
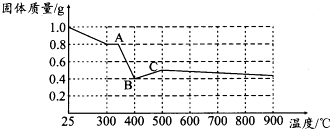 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:e>d | |
| B. | 原子半径:r(e)>r(d) | |
| C. | 最高价氧化物对应水化物的酸性:c<d | |
| D. | a、b可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C0和H2混合物lmol.完全燃烧消耗O2的分子数为0.5NA | |
| B. | lmolCnH2n+2 所含的共用电子对数为(3n+l)NA | |
| C. | 标准状况下,22.4L甲醇所含的分子数目为NA | |
| D. | 高温下,33.6g Fe与足量水蒸气反应,生成的H2分子数目为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
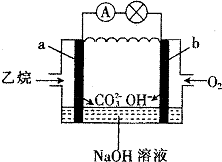
| A. | a为负极,电极反应式为CH3CH3-14e-+18OH-═2CO32-+12H2O | |
| B. | 电子从a极经导线移向b极,再经溶液移向a极 | |
| C. | 电池工作一段时间后电解质溶液的pH增大 | |
| D. | 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com