
 ���������к��еĻ�ѧ�������Ӽ������ۼ���
���������к��еĻ�ѧ�������Ӽ������ۼ��� ��
������ A��B��C��D��E���ֶ�����Ԫ�أ�A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�AΪHԪ�أ�����B��Cͬ���ڣ�B��Dͬ���壬ԭ�Ӱ뾶E��D��B��C��A����B��CΪ�ڶ�����Ԫ�أ�D��EΪ��������Ԫ�أ�Dԭ��������������Eԭ��������������4����E������������ֻ��Ϊ1��EΪNa��DΪSi��B��Dͬ���壬��֪BΪC����Dԭ�Ӻ�������������B��Cԭ�ӵ�����֮�ͣ�C�ĵ�����Ϊ14-6=8����CΪO���Դ������
��� �⣺������������֪��AΪH��BΪC��CΪO��DΪSi��EΪNa��
��1���ǽ�����O��C��Si�����⻯���ȶ���H2O��CH4��SiH4���ʴ�Ϊ��H2O��CH4��SiH4��
��2��A��B�γɵ���ԭ�ӷ��Ӽ�ΪCO2������ʽ��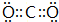 ���ṹʽΪO=C=O��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ���������Na2O2������ʽ��
���ṹʽΪO=C=O��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ���������Na2O2������ʽ��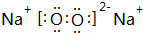 �������Ӽ������ۼ���
�������Ӽ������ۼ���
�ʴ�Ϊ��O=C=O�� �����Ӽ������ۼ���
�����Ӽ������ۼ���
��3�����ҷ�Ӧ�Ļ�ѧ����ʽ��2CO2+2Na2O2�T2Na2CO3+O2���ʴ�Ϊ��2CO2+2Na2O2�T2Na2CO3+O2��
��4��A��B�γɵĻ�����֮һ����һ����Ҫ�Ļ�������ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ����Ϊ��ϩ���Ƶø߾���ķ�Ӧ����ʽΪnCH2�TCH2$\stackrel{����}{��}$ ���÷�Ӧ�����ǼӾ۷�Ӧ��
���÷�Ӧ�����ǼӾ۷�Ӧ��
�ʴ�Ϊ��nCH2�TCH2$\stackrel{����}{��}$ ���Ӿ۷�Ӧ��
���Ӿ۷�Ӧ��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɣ�Ϊ��Ƶ���㣬����Ԫ�ص����ʡ�Ԫ�ص�λ�á�ԭ�ӽṹ���ƶ�Ԫ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�⻯ѧ�����ʹ�ã���Ŀ�ѶȲ���


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ijһ�ݻ�Ϊ5L���ܱ������ڣ����� 0.2mol��CO��0.2mol��H2O���ڴ������ں�800��������¼��ȣ��������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g������H��0��Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
��ijһ�ݻ�Ϊ5L���ܱ������ڣ����� 0.2mol��CO��0.2mol��H2O���ڴ������ں�800��������¼��ȣ��������·�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g������H��0��Ӧ��CO2��Ũ����ʱ��仯�����ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij�¶�ʱ����һ���ݻ�Ϊ2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
ij�¶�ʱ����һ���ݻ�Ϊ2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | ��ʼ������pH | ������ȫ��pH | ���� | 20��ʱ�ܽ��ԣ�H2O�� | |
| Fe3+ | 1.1 | 3.2 | CaSO4 | �� | |
| Fe2+ | 5.8 | 8.8 | NiF | ���� | |
| Al3+ | 3.0 | 5.0 | CaF2 | ���� | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6��10-4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ݻ�Ϊ 1.0L ���ܱ������н��з�Ӧ��A��g��=B��g��+C��g����A �ij�ʼŨ��Ϊ 0.5mol?L-1�����¶�T1��T2 �£�A ��Ũ����ʱ���ϵ��ͼ��ʾ���ش��������⣺
���ݻ�Ϊ 1.0L ���ܱ������н��з�Ӧ��A��g��=B��g��+C��g����A �ij�ʼŨ��Ϊ 0.5mol?L-1�����¶�T1��T2 �£�A ��Ũ����ʱ���ϵ��ͼ��ʾ���ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com