
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=___kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是___。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是___。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是___。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程为:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程为:
![]()
写出阳极生成二聚体的电极反应式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:___。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的优点除了F-残留率比较低之外,还有___。

③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,溶液pH增大,使少量MgF2转化为Mg(OH)2,F-含量略有升高,此时溶液中的![]() =___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
=___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
【答案】![]() pH过小,H+与F-转化为弱酸HF Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力 2
pH过小,H+与F-转化为弱酸HF Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力 2![]() -2e-=
-2e-=![]() +2H+ MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl 所得溶液接近中性 4
+2H+ MgCl2+CO(NH2)2+2H2O=MgCO3↓+2NH4Cl 所得溶液接近中性 4
【解析】
(1)根据盖斯定律进行计算;
(2)①pH过小氢离子浓度大,结合氟离子,所测F-浓度偏低;
②Fe3+与柠檬酸根(C6H5O73-)的结合减少了与氟离子的结合;
(3)用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应;
)和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应;
(4)①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3和氯化铵,原子守恒配平书写化学方程式;
②分析柱状图可知取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3,相同时间内,碳酸镁处理后氟离子含量最少,溶液pH接近7;
③Ksp(MgF2)=c(Mg2+)·c2(F-)=8.0×10-11,Ksp[Mg(OH)2]= c(Mg2+)·c2(OH -),据此进行计算。
(1)①3H2SiF6(aq)+2Al(OH)3(s)═Al2(SiF6)3(aq)+6H2O(l)△H=a kJmol-1
②Al2(SiF6)3(aq)+6H2O(l)═2AlF3(aq)+3SiO2(s)+12HF(aq)△H=b kJmol-1
③3HF(aq)+Al(OH)3(s)═AlF3(aq)+3H2O(l)△H=c kJmol-1
盖斯定律计算(①+②+③×4)×![]() 得到反应H2SiF6(aq)+2Al(OH)3(s)═2AlF3(aq)+SiO2(s)+4H2O(l)的△H=
得到反应H2SiF6(aq)+2Al(OH)3(s)═2AlF3(aq)+SiO2(s)+4H2O(l)的△H=![]() kJ/mol。
kJ/mol。
(2)①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是:pH过小,H+与F-转化为弱酸HF;
②Fe3+与柠檬酸根(C6H5O73-)的结合能力强于其与F-的结合能力。
(3)用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,苯胺失电子生成二聚体,结合电子守恒、电荷守恒、原子守恒写出电极反应:![]() ;
;
(4)①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3和氯化铵,原子守恒配平书写化学方程式:MgCl2+CO(NH2)2+2H2O═MgCO3↓+2NH4Cl;
②根据图示分析可知相同条件下,使用MgCO3处理后的废水中F-残留量最低,溶液接近中性,故答案为:所得溶液接近中性;
③Ksp(MgF2)=c(Mg2+)·c2(F-)=8.0×10-11,Ksp[Mg(OH)2]= c(Mg2+)·c2(OH -)=5×10-12,溶液中存在,MgF2(s)+2OH-(aq)=Mg(OH)2(s)+2F-(aq),则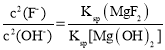 ,所以
,所以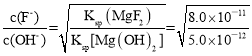 =4。
=4。


科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为![]() ,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的
,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的![]() ,又制得电池材料
,又制得电池材料![]() (反应条件已省略).请回答下列问题:
(反应条件已省略).请回答下列问题:
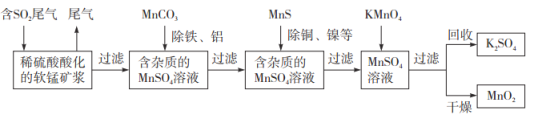
(1)上述流程脱硫实现了________(填编号).
a.废弃物的综合利用 b.“白色污染”的减少
c.酸雨的减少 d.臭氧层空洞的减小
(2)已知:25℃,101kPa时,![]()
![]() ,
,![]()
![]() ,
,![]()
![]() 。则步骤Ⅰ中
。则步骤Ⅰ中![]() 与
与![]() 反应生成无水
反应生成无水![]() 的热化学方程式是__________。
的热化学方程式是__________。
(3)用离子方程式表示出步骤Ⅱ中用![]() 除去
除去![]() 的反应原理:__________。
的反应原理:__________。
(4)已知![]() ;在步骤Ⅲ除铜镍的过程中,当
;在步骤Ⅲ除铜镍的过程中,当![]() 恰好完全沉淀[此时溶液中
恰好完全沉淀[此时溶液中![]() ],则溶液中
],则溶液中![]() 的浓度是_________mol/L。
的浓度是_________mol/L。
(5)步骤Ⅳ生成无水![]() 的化学方程式是___________。
的化学方程式是___________。
(6)产品![]() 可作超级电容材料.用惰性电极电解
可作超级电容材料.用惰性电极电解![]() 溶液可以制得
溶液可以制得![]() ,其阳极的电极反应式是________________________。
,其阳极的电极反应式是________________________。
(7)已知废气中![]() 浓度为
浓度为![]() ,软锰矿浆对
,软锰矿浆对![]() 的吸收率可达90%,则处理
的吸收率可达90%,则处理![]() 燃煤尾气,可得到硫酸锰晶体(
燃煤尾气,可得到硫酸锰晶体(![]() ,相对分子质量为169)的质量为_____kg(结果保留3位有效数字)。
,相对分子质量为169)的质量为_____kg(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置闭合电键时,电流表A的指针将发生偏转。试回答下列问题。

(1)A池是________,Zn的电极名称是________;B池是________,Pt的电极名称是________。
(2)写出下列有关反应:
Zn极上电极反应:___________________________________________;
Pt极上电极反应:___________________________________________。
(3)B池中的总反应的化学方程式为_________________________________。
(4)如果要用B池给铁片上镀上一层Cu,则B池应作何改进___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是_______;O3消毒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )

A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 CO2 在一定条件下与 H2 反应转化为甲醇(CH3OH)是变废为宝的好办法,一定条件下,每转化 44 kg CO2 放出的热量为 49000 kJ,CO2 转化为甲醇过程中浓度随时间的变化曲线如图所示(已知反应物和生成物在此条件下均为气体),下列叙述中正确的是

A. 0~3 min 内,用 CO2 和 H2 来表达的平均反应速率相等,均为 0.5 mol/(L·min)
B. 此反应的热化学方程式为 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H = - 49 kJ/mol
C. 此条件下反应的平衡常数K=0.753×1.25/(0.75×0.75)
D. 降低温度,此反应的平衡常数可能为 0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中离子的数目减小
B. 再加入CH3COONa固体能促进醋酸的电离
C. 醋酸的电离程度增大,c(H+)亦增大
D. 溶液中c(CH3COO-)/c(CH3COOH)c(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( )

A.甲池通入![]() 的电极反应式为
的电极反应式为![]()
B.反应一段时间后,丙池中硫酸铜浓度不变
C.当甲池中消耗标况下![]() 时,丙池中粗铜端减重
时,丙池中粗铜端减重![]()
D.乙池中生成白色物质,若将乙醇与氧气互换,乙池中仍生成白色物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com