
【题目】在一密闭容器中进行反应:![]() ,已知反应过程中某一时刻
,已知反应过程中某一时刻![]() 、
、![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() 、
、![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A.![]() 为
为![]() 、
、![]() 为
为![]() B.
B.![]() 为
为![]()
C.![]() 为
为![]() 、
、![]() 为
为![]() D.
D.![]() 和
和![]() 均为
均为![]()
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
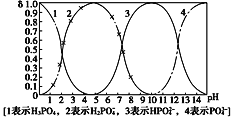
(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为________。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是__________。
(2)从图中推断NaH2PO4溶液呈______性(填“酸”“碱”或“中”),其原因是_________。
(3)在Na3PO4溶液中,c(Na+)/c(PO43-)______3(填“>”“=”或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的的是( )
A. 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯
B. 用酸性高锰酸钾溶液即可检验CH2=CH-CHO中的碳碳双键
C. 将![]() 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
D. 淀粉在硫酸催化作用下水解,将银氨溶液加入到水解后的溶液中可检验淀粉水解的产物葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出以下物质的电子式:
Na2O2:___;H2S:___;NaHS:___。
(2)用“>”或“<”回答下列问题:
酸性:H2SiO3___H3PO4;稳定性:HCl___CH4;氧化性:Cu2+___Fe3+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ①④⑤⑥⑦⑧C. ③④⑤⑥⑦D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。
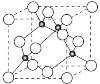
①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。
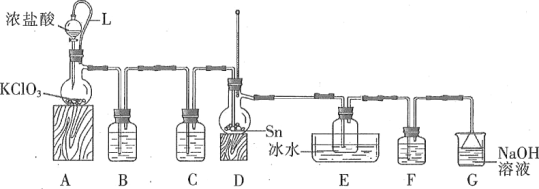
(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
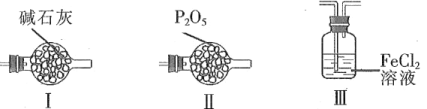
(4)F和G装置可以用下列装置代替的是____。(填代号)
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机物A为一种无色液体,从A出发可发生如下一系列反应:
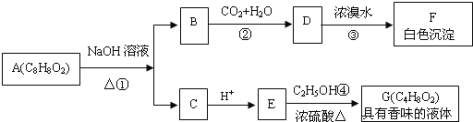
请回答:
(1)E中的官能团名称是_________。
(2)A的结构简式为_________。
(3)写出反应①的化学方程式:_____________,该反应的反应类型是_________。
(4)写出反应③的化学方程式:______________________。
(5)符合下列条件的A的同分异构体有_____(不考虑立体异构)种,写出其中一种的结构简式:______________。
①苯环上有两个取代基 ②能发生水解反应 ③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2OB.Sn(NO3)4
C.Sn(NO3)2D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com