
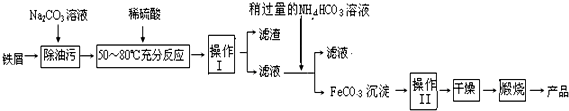
分析 (1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,与过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化镁、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+;
(3)①由工艺流程可知,操作I是将固体与液体分离,应采取过量的方法;FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质;
②由工艺流程可知,操作I所得的滤液中主要有硫酸亚铁,加入碳酸氢铵,实质是亚铁离子与碳酸氢根离子反应,生成FeCO3,同时生成二氧化碳、水;
(4)①配制溶液需要容量瓶;定容时俯视刻度线,体积偏小,结合c=$\frac{n}{V}$分析;
②根据5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O计算.
解答 解:(1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,溶液有剩余的HCl,溶液中大量存在的阳离子是Fe2+、Fe3+、H+,故答案为:Fe2+、Fe3+、H+;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化镁、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,
故答案为:BC;
(3)①由工艺流程可知,操作I是将固体与液体分离,应采取过滤的方法;FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质,
故答案为:过滤;洗涤;
②在空气中煅烧FeCO3的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
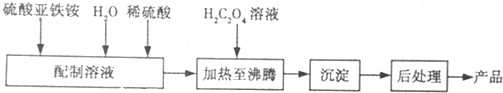
(4)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需250 mL容量瓶,定容时俯视刻度线,体积偏小,由c=$\frac{n}{V}$可知,c偏大,故答案为:250mL容量瓶;偏大;
②n(MnO4-)=0.01000mol/L×0.02L=2×10-4mol,则由5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O可知n(Fe2+)=5×2×10-4mol=1×10-3mol,
所以250mL溶液中含有知n(Fe2+)=1×10-2mol,
则m(FeSO4•7H2O)=278g/mol×1×10-2mol=2.780g,
样品中FeSO4•7H2O的质量分数为$\frac{2.780g}{2.850g}$=0.975,
故答案为:0.975.
点评 本题考查物质的制备实验及含量测定计算,为高频考点,把握制备流程中的反应、混合物分离方法、反应中物质的量关系为解答的关键,侧重分析与计算、实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
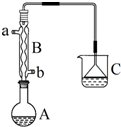 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com