
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A.0.1 mol 氦气所含有的原子数为0.2NA
B.标准状况下,22.4 L水中含有的氧原子数为NA
C.1 mol H2的质量只有在标准状况下才约为2 g
D.18g H2O和NA 个OH—中含有的电子数均为10 NA
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取不同质量的镁铝合金样品分别与30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
通过计算求:
(1)该盐酸的物质的量浓度
(2)合金中镁的质量分数
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是五种短周期原子序数依次递增的主族元素,乙、丁、戊在周期表的相对位置如右图。甲能与丙形成四核10电子的分子,则下列说法正确的是( )
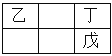
A. 丙的非金属性强,丙单质的氧化性也强
B. 甲与乙、甲与丁都能形成原子个数比1: 1和2:1的分子
C. 丁的氢化物沸点高于戊的氢化物沸点说明丁的非金属性比戊强
D. 简单阴离子还原性:丁>戊,简单阴离子半径:丁>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验法是化学重要的研究物质性质的基本方法。某化学研究小组进行了如下实验,请回答问题。
(1)用脱脂棉包住过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,看到脱脂棉剧烈燃烧起来。
①由上述实验现象所得到的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二,________________________。
Na2O2跟水反应的化学方程式是______________________,
如果有1 mol O2生成,则转移____________mol 电子。
②该研究小组拟用下图所示装置(气密性良好)证明上述结论。
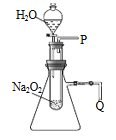
用以验证第二条结论的实验操作及现象是:_____________________。
(2)①将光亮的无锈铁钉放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________。
②另称取铁钉6.0g放入15.0 mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应选用的试剂编号为______。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
乙同学把气体Y通入足量氯水中,写出发生反应的离子方程式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A.边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B.当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C.上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D.滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )

A、反应速率:v(B)<v(A) B、A容器中X的转化率为80%
C、平衡时的压强:2p(A)=p(B) D、平衡时Y的体积分数:A>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com