
 .
.| pH | 1 | 3 | 5 | 7 | 9 | 11 | 13 |
| c(S2-) | 1.4×10-19 | 1.4×10-15 | 1.4×10-11 | 6.7×10-7 | 1.9×10-5 | 1.3×10-3 | 5.7×10-2 |
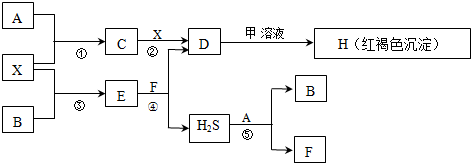
分析 红褐色沉淀H为Fe(OH)3,由题意知A在常温下为非金属单质气体,X是一种金属单质,结合质量守恒定律可推知X为Fe,甲是短周期元素形成的盐,且是某种消毒液的有效成分,结合反应①②知A为Cl2,C为FeCl3、D为FeCl2,甲为NaClO,NaClO溶液产生与FeCl2反应,一方面FeCl2被NaClO氧化为Fe3+,另一方面Fe3+与ClO-发生双水解反应生成Fe(OH)3和HClO,由题意知B是非金属单质固体,由反应③④可知,B为硫、E为FeS、F为HCl、G为H2S,反应⑤为氯气与硫化氢反应生成S与HCl,符合转化关系,据此解答.
解答 解:红褐色沉淀H为Fe(OH)3,由题意知A在常温下为非金属单质气体,X是一种金属单质,结合质量守恒定律可推知X为Fe,甲是短周期元素形成的盐,且是某种消毒液的有效成分,结合反应①②知A为Cl2,C为FeCl3、D为FeCl2,甲为NaClO,NaClO溶液产生与FeCl2反应,一方面FeCl2被NaClO氧化为Fe3+,另一方面Fe3+与ClO-发生双水解反应生成Fe(OH)3和HClO,由题意知B是非金属单质固体,由反应③④可知,B为硫、E为FeS、F为HCl、G为H2S,反应⑤为氯气与硫化氢反应生成S与HCl,符合转化关系,
(1)D中阳离子为Fe2+,鉴定Fe2+的操作和现象是向少量D溶液中滴入几滴KSCN溶液,无现象,再加入H2O2溶液,溶液显红色.说明D中有Fe2+离子,
故答案为:向少量D溶液中滴入几滴KSCN溶液,无现象,再加入H2O2溶液,溶液显红色.说明D中有Fe2+离子;
(2)A为Cl2,B为硫,A与B在一定条件下反应生成一种原子个数比为1:1的分子Y为S2Cl2,Y的电子式为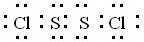 ,
,
故答案为: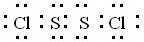 ;
;
(3)根据上面的分析可知,甲是NaClO,NaClO溶液产生与FeCl2反应,一方面FeCl2被NaClO氧化为Fe3+,另一方面Fe3+与ClO-发生双水解反应生成Fe(OH)3和HClO,所以此时甲溶液表现的性质是氧化性、碱性,将甲溶液与FeCl3溶液混合,也能迅速生成Fe(OH)3,反应的离子方程式为Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO,
故答案为:NaClO;氧化性、碱性;Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO;
(4)反应⑤是氯气与硫化氢反应生成S与HCl,反应方程式为:H2S+Cl2=S↓+2HCl,
故答案为:H2S+Cl2=S↓+2HCl;
(5)①根据硫元素守恒可知,c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)-)=0.10 mol•L-1-c(S2-)=(0.10-5.7×10-2)mol•L-1=0.043mol•L-1,
故答案为:0.043;
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,根据Ksp(MnS)=c(Mn2+)•c(S2-),c(S2-)=$\frac{K{\;}_{sp}(MnS)}{c(Mn{\;}^{2+})}$=1.4×10-11mol•L-1,对比题中表中的数据可知,此时溶液的pH=5,
故答案为:5.
点评 本题考查无机物推断,物质的颜色是推断突破口,再利用元素守恒推断X为Fe,结合中学常见物质及转化关系进行推断,需要学生具备扎实的基础与逻辑推理能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.025mol | B. | 0.05mol | C. | 0.075mol | D. | 0.10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
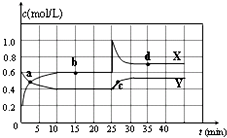 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)表示的化学反应速率为0.2 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,不可能是将密闭容器的体积缩小为1L引起的 | |
| D. | 前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该过程中CeO2没有消耗 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 如图中△H1=△H2+△H3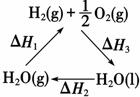 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 使红色布条褪色(HCl) | |
| C. | 使淀粉KI试纸变蓝(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
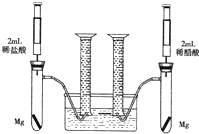 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法不正确的是( )
下列说法不正确的是( )| A. | 该药物在人体胃液中能发生水解反应 | |
| B. | 其水解产物中可能有乙二醇 | |
| C. | 其水解产物中可能有芳香族化合物 | |
| D. | 该高分子化合物通过缩聚反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.55 |
| 2 | 20.00 | 6.00 | 25.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com