
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
B.CO2分子是直线型,杂化类型为SP杂化,分子构型与键的夹角无关;
C.氢键的存在导致H2O的沸点较高;
D.HF的稳定性很强,是由于H-F键键能较大的原因,与氢键无关.
解答 解:A.N、O属于同一周期元素且原子序数依次增大,但氮原子2p能级半充满,比较稳定,所以氮原子的第一电离能大于氧原子,故A正确;
B.理论解释不对,CO2分子的价层电子对是2,根据价层电子对互斥理论,CO2分子是直线型,但与键的夹角无关,故B错误;
C.氧族元素氢化物都属于分子晶体,分子晶体的沸点与其相对分子质量成正比,但水中含有氢键,硫化氢中不含氢键,导致水沸点高于硫化氢,理论解释不对,故C错误;
D.HF比HCl稳定,是因为HF的键能比HCl的大,与氢键无关,故D错误;
故选A.
点评 本题考查较综合,涉及第一电离能、键角、氢键与熔点的关系等知识点,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 单质氧化性:③>①>② | ||
| C. | 电负性:③>②>① | D. | 原子半径:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g羟基与17g NH3所含电子数均为10NA | |
| B. | lmolCl2溶于水转移电子数为NA | |
| C. | 1L0.1mol•L-1 NH4 HC03溶液中所含NH4+数为0.1NA | |
| D. | 标准状况下,11.2LN2和02混合气体中所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出A分子中官能团的名称羧基、羟基;
;写出A分子中官能团的名称羧基、羟基;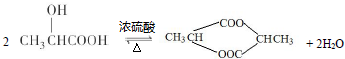 ;
;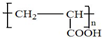 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
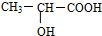 ,回答下列问题:
,回答下列问题: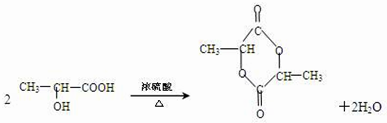
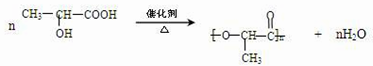
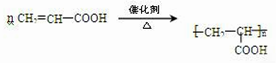 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子氧化性:A(n+1)+>Bn+离子还原性:C(n+1)->Dn- | |
| D. | 单质还原性:A>B,单质氧化性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
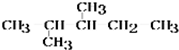
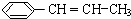 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: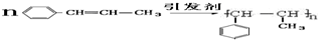
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 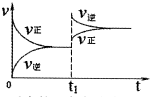 反应的正方向放热(t1时升温) | |
| B. | 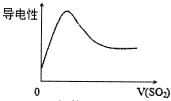 SO2气体通入氯水中 | |
| C. | 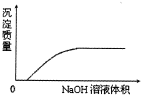 NaOH溶液滴加Ca(HCO3)2溶液中 | |
| D. | 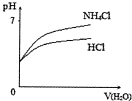 将PH相同的NH4Cl溶液和稀盐酸稀释时PH的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com