
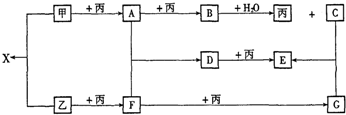
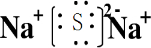 ,GSO3;
,GSO3;分析 单质甲、乙均能分别与单质丙连续两次反应,可能是单质甲、乙分别被O2连续两次氧化,生成不同的氧化物,则丙是O2.氧化物B与水反应能放出O2,则B是Na2O2,那么C是NaOH,A是Na2O,甲是Na.又因B和X的摩尔质量相同,则X是Na2S,那么乙是S,F是SO2,G是SO3.进一步推出D是Na2SO3,E是Na2SO4,而Na2SO4的相对分子质量比Na2SO3的相对分子质量大16,符合题意,结合对应物质的性质以及题目要求可解答该题.
解答 解:单质甲、乙均能分别与单质丙连续两次反应,可能是单质甲、乙分别被O2连续两次氧化,生成不同的氧化物,则丙是O2.氧化物B与水反应能放出O2,则B是Na2O2,那么C是NaOH,A是Na2O,甲是Na.又因B和X的摩尔质量相同,则X是Na2S,那么乙是S,F是SO2,G是SO3.进一步推出D是Na2SO3,E是Na2SO4,而Na2SO4的相对分子质量比Na2SO3的相对分子质量大16,符合题意,
(1)X为Na2S,为离子化合物,电子式为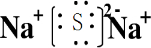 ,G是SO3,
,G是SO3,
故答案为: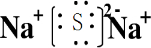 ;SO3;
;SO3;
(2)B和水的反应为2Na2O2+2H2O=4NaOH+O2↑,D和丙的反应为2Na2SO3+O2=2Na2SO4,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2Na2SO3+O2=2Na2SO4.
点评 本题考查了无机物的推断,为高频考点,侧重于物质转化关系的综合应用、物质性质的应用、反应现象的判断和特征应用,注意连续氧化的反应类型及应用,掌握常见物质的性质和反应特征、反应条件是解题关键,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液;挤压滴管的胶头,下列与试验事实不相符的是( )| A. | SO2(NaHSO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | H2S(CuSO4溶液) 黑色喷泉 | D. | HCl(AgNO3溶液) 白色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和CH3-CH2-CH=CH2 | B. | CH3-CH3和CH3-CH=CH2 | ||
| C. | CH3-CH2-CH3和CH3-CH=CH2 | D. | CH3-CH2-CH2-CH3和CH3-CH2-CHCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
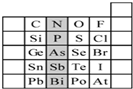 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点由高到低:癸烷、正已烷、新戊烷、正戊烷 | |
| B. | 酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,又可以用来除去甲烷中的少量乙烯 | |
| C. | 乙烯的化学性质比乙烷活泼,可作香蕉等水果的催熟剂 | |
| D. | 苯可以通过石油分馏或煤焦油的催化重整获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
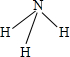 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为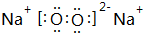 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
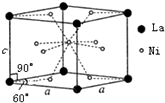 Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.
Ni和La的合金是目前使用广泛的储氢材料.该合金的晶胞结构如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com