
(17分)按要求回答下列问题:
(1)实验室铝粉和Fe2O3作铝热反应实验,铝热反应的方程式为_________,该实验中除用到铝粉和Fe2O3外,需要的试剂还有 (填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
(2)据文献报道,在实际反应中铝热反应的产物成分较为复杂。某课题组对铝热反应产物的成分进行探究,经成分分析,发现主要得到甲和乙两种产物。甲由具有相同电子层结构的阴、阳离子构成;乙是一种铁铝的金属互化物(可用FexAly表示),取该合金粉末2.47g,滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g。
①甲的化学式为______,乙中x=_____,y=_______。
②甲的晶体是耐高温材料,用此材料做成的坩埚,不能用来熔融NaOH,用化学方程式解释其原因______;含二氧化硅材料做成的坩埚_____(填“能”或“不能”)用来熔融NaOH。
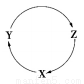
③下图表示室温下相同组分的乙分别在两种不同的酸中的腐蚀情况,
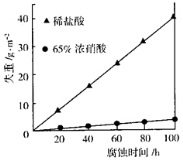
由图可知,乙在______中具有比较强的抗腐蚀性,原因可能是______。
④研究发现铝热反应后期温度高达2000℃以上时会有极微量的Al4C3生成,Al4C3遇水会产生一种气体,该气体的分子式为________。[已知CaC2+2H2O=Ca(OH)2+C2H2↑]
(3)镁铝互化物(Mg17Al12)是一种潜在的贮氢材料,该金属互化物在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物在6.0 mol·L-1 HCl中,能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为________。
(17分,除标明分值外,其余每空均为2分。)
(1)2Al+Fe2O3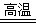 Al2O3+2Fe(不写条件扣1分);a、b(少1个扣1分,错1个倒扣1分)。
Al2O3+2Fe(不写条件扣1分);a、b(少1个扣1分,错1个倒扣1分)。
(2)①Al2O3;2,5;(每空均为1分) ②Al2O3+2NaOH+3H2O=2Na[Al(OH)]4 ;不能(1分)
③65%浓硝酸(1分),遇浓硝酸表面钝化,阻碍进一步反应(只要体现出“钝化”即可)
④CH4(3)52mol
【解析】
试题分析:(1)铝与氧化铁发生铝热反应的方程式为2Al+Fe2O3 Al2O3+2Fe;该实验中除用到铝粉和Fe2O3外,需要的试剂还有氯酸钾和镁,答案选ab。
Al2O3+2Fe;该实验中除用到铝粉和Fe2O3外,需要的试剂还有氯酸钾和镁,答案选ab。
(2)①甲由具有相同电子层结构的阴、阳离子构成,则甲是Al2O3;取该合金粉末2.47g,滴加足量浓NaOH溶液,其中铝溶解转化为偏铝酸钠。充分搅拌、过滤、洗涤得固体铁。再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g,所以红棕色粉末应该是氧化铁,物质的量是1.60g÷160g/mol=0.01mol。根据铁原子守恒可知铁的物质的量是0.02mol,质量是0.02mol×56g/mol=1.12g,因此合金中铝的质量是2.47g-1.12g=1.35g,物质的量是1.35g÷27g/mol=0.05mol,所以x:y=0.02:0.05=2:5,则x=2、y=5。
②在加热的条件下氧化铝与氢氧化钠反应,方程式为Al2O3+2NaOH+3H2O=2Na[Al(OH)]4;二氧化硅与能与氢氧化钠反应生成硅酸钠和水,所以含二氧化硅材料做成的坩埚不能用来熔融NaOH。
③根据图像可知乙在65%浓硝酸中具有比较强的抗腐蚀性,这是由于常温下遇浓硝酸表面钝化,阻碍进一步反应。
④Al4C3遇水会产生一种气体,则根据CaC2+2H2O=Ca(OH)2+C2H2↑可推测,Al4C3与水反应生成氢氧化铝和甲烷,因此该气体的分子式为CH4。
(3)1 mol Mg17Al12完全吸氢后可以吸收17mol氢气,因此释放时可以再释放出17mol氢气。同时镁和铝也分别都能与盐酸反应放出氢气。1 mol Mg17Al12中含有17mol镁、12mol铝,与元素反应分别放出17mol氢气和12mol×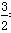 =18mol氢气,则得到的混合物与上述盐酸完全反应,释放出H2的物质的量为17mol+17mol+18mol=52mol。
=18mol氢气,则得到的混合物与上述盐酸完全反应,释放出H2的物质的量为17mol+17mol+18mol=52mol。
考点:考查金属镁、铝、铁等有关性质与计算


科目:高中化学 来源:2015届山东省泰安市高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 L CCl4中含有的C Cl键的个数为2NA
Cl键的个数为2NA
B.1 mol Na2O和Na2O2中含有的阴、阳离子总数是3 NA
C.常温下,0.1 mol Cl2通入NaOH溶液中充分反应,转移电子数为0.2 NA
D.1 L 0.1 mol·L-1氨水溶液中所含的离子和分子总数大于0.1 NA但小于0.2 NA
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次检测化学试试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电了数为0.3NA
B.7.8gNa2S和 Na2O2的固体混合物中含有的阴离子数大于0.1NA
C.50mL l8.4mol·L-1浓浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
D.常温常压下,46gNO2和N2O4的混合物中含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
2H2(g)+ O2(g)===2H2O(g) ΔH2 C(s)+ O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g) + O2(g) +6N2(g)的ΔH为( )
A.12ΔH3+5ΔH2-2ΔH1 B.2ΔH1-5ΔH2-12ΔH3
C.12ΔH3-5ΔH2-2ΔH1 D.ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:选择题
铅蓄电池是一种用途极广的二次电池,其电池反应为:
下列说法不正确的是
A.放电时,负极质量增加
B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接
C.放电时,正极反应为:
D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(B卷)(解析版) 题型:选择题
A、B、C、D、E为短周期元素,其原子序数依次增大。其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子。则下列说法正确的是
A.D氢化物的稳定性比B氢化物的稳定性强
B.5种元素中,E元素氧化物的水合物的酸性最强
C.A与B、D分别可形成AB2、AD2的化合物
D.B和C可形成离子化合物,且C离子的半径大于B离子的半径
查看答案和解析>>
科目:高中化学 来源:2015届山东省文登市高三上学期11月月考化学试卷(A卷)(解析版) 题型:填空题
(18分)通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力。
(1)如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。按要求回答问题:
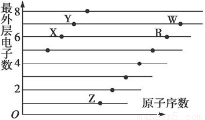
①Y元素在元素周期表中的位置为__________。
②气态氢化物的稳定性:X_____(填“>”“<”)Y。
③这五种元素形成的简单离子中,离子半径最大的是_______(填离子符号)。
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为_____________。
(2)X、Y、Z三种物质有以下转化关系:
①如果三种物质中均含Mg元素,且X为镁单质,则Y、Z可能是_____、_______(填化学式,只填一种物质即可,下同);
②如果三种物质中均含Cl元素,且X为Cl2,则Y、Z可能是_____、______;
③如果三种物质中均含Si元素,且X为SiO2,则Y、Z可能是_____、______。
(3)向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,生成沉淀质量m与Ba(OH)2体积V之间的关系,则oa段生成的沉淀为____(填化学式,下同),ab段生成的沉淀为_____;bc段生成的沉淀为_________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省德州市高三期中考试化学试卷(解析版) 题型:选择题
下列有关物质的性质及应用说法正确的是
A.Si具有导电性,可用作半导体材料
B.难熔的Al2O3制成的坩埚,可用于熔融烧碱
C.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
D.Cl2和SO2均有漂白性,均可使含有酚酞的NaOH溶液褪色
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第一次模拟考试试卷(解析版) 题型:选择题
下列反应中,改变反应物的用量或浓度,不会改变生成物的是( )
A.铜和硝酸反应
B.二氧化碳通入氢氧化钠溶液中
C.细铁丝在氯气中燃烧
D.氯化铝与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com