
对于2X(g)![]() Y(g)的体系,在压强一定时,平衡体系中Y的质量分数ω(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数ω(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).

(1)该反应的正反应方向是一个________反应(填“吸热”或“放热”).
(2)A,B,C,D,E各状态中,v(正)<v(逆)的是________.
(3)维持t1不变,E![]() A所需时间为x,维持t2不变,D
A所需时间为x,维持t2不变,D![]() C所需时间为y,则x________y(填“<”,“>”,“=”).
C所需时间为y,则x________y(填“<”,“>”,“=”).
(4)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上讲,可采取的措施是________.
|
(1)放热;(2)D;(3)>;(4)先突然升温到t2,然后无限缓慢地降低温度到t1 【巧解导析】由图可知,随着温度的升高,ω(Y)逐渐减少,说明平衡逆向移动,则正反应方向是放热反应.A,B,C,D,E中A,B,C在平衡曲线上,则A,B,C都处于各自平衡状态中,D,E两点不在平衡曲线上,即它们没有达到化学平衡,因为E状态的ω(Y)比该温度下的平衡时ω(Y)小,所以平衡正向移动,v(正)>v(逆),D状态的ω(Y)比该温度下的平衡状态时的ω(Y)大,平衡逆向移动,此时v(逆)>v(正).D,E要达到各自温度下的平衡状态所转化Y的物质的量相同,又因为D处的温度比E处的温度高,D处反应速率快,所以D处达到平衡所需时间短.E |
|
【巧解点悟】解题关键点:温度升高,化学平衡向着吸热反应方向移动,其他条件相同时,温度高,反应达到平衡所需时间短,曲线上点的意义.易错点:不能正确看图、识图. |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:黑龙江省哈四中2009-2010学年高二上学期期中考试化学(理科)试题 题型:022
对于2X(g)![]() Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
Y(g)的体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).

(1)该反应的正反应方向是一个________反应(填“吸热”或“放热”).
(2)A、B、C、D、E各状态中,
v正<v逆的是________.(3)维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x________y(填“<、>或=”).
(4)欲要求使E状态从水平方向到C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向正反应方向移动
D.正、逆反应速率都增大,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2X(g)+Y(g)![]() 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( )
2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( )
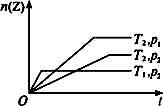
A.T1<T2,p1<p2,正反应为放热反应
B.T1<T2,p1>p2,正反应为吸热反应
C.T1>T2,p1>p2,正反应为放热反应
D.T1>T2,p1<p2,正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2012届湖北省高二上学期期末考试化学试卷 题型:选择题
对于反应2X(g)+Y(g)
 2Z(g),下列说法正确的是
2Z(g),下列说法正确的是
A.由于K=CZ2/(CX2CY),随着反应的进行,Z的浓度不断增大,X,Y的浓度不断减小,平衡常数不断增大
B.当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大
C.可逆反应达到平衡时,逆反应便立即停止了
D.温度发生变化,上述的K值也发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com