

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
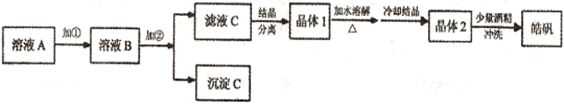 (l���Ʊ�𩷯��ʵ����������ͼ��ʾ��
(l���Ʊ�𩷯��ʵ����������ͼ��ʾ��| | ��ʼ���� | ������ȫ |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ʵ���Ũ�����CH3COOH��CH3COONa��Һ�������ϣ�c(CH3COO-) + c(CH3COOH)=2c(Na+) |
| B�����ʵ���Ũ�����Na2CO3��NaHCO3��Һ�������ϣ�����Ũ�ȵĴ�С˳����: c (Na+)>c (HCO3-)> c(CO32��)>c(OH-)> c(H��) |
| C��0.1 mol/L Na2CO3��Һ��c(OH��)��c(HCO3��)��c(H��)��c(H2CO3) |
| D��CH3COONa��Һ��c(OH-) = c(CH3COOH) +c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ�����Ե���һ����ǿ����ǿ�����ɵ��� |
| B��������������ӵ��ε�ˮ��Һһ���ʼ��� |
| C������Һ���������Ҫ�������γ��ε��ᡢ�����̶ȵ���Դ�С |
D��Na2 Sˮ������ӷ���ʽΪ��S2��+2H2O H2S+2OH- H2S+2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ | B������ | C������ | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(CH3COOH)��c(CH3COO��) | B��c(CH3COO��)��c(CH3COOH)��0.1 mol��L��1 |
| C��c(H��)��c(OH��) | D��c(CH3COO��)��c(OH��)��0.1��mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
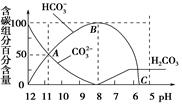
| A��0.1 mol/L Na2CO3��Һ��c(OH��)��c(H��)��2c(H2CO3)��c(HCO3��) |
| B����A��c(Na��)��c(CO32��)��c(HCO3��)��c(OH��)��c(H��)�� |
| C��������CO2������Һ��pHԼΪ5.6 |
| D��0.05 mol/L NaHCO3��Һ��pH��8 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com