
 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂. .
.| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
分析 (1)①一氯胺(NH2Cl)为共价化合物,氮原子与氢原子、氯原子之间形成1对共用电子对;
②氯胺(NH2Cl)为共价化合物,NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g),△H=反应物的键能之和-生成物的键能之和;
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解生成氨气和次氯酸;
(2)①反应速率v=$\frac{△c}{△t}$;
②根据数据,在400℃时,甲容器,平衡后0.8mol,乙容器中1.00mol,达到平衡时间短说明反应速率大,乙中剩余氯气应少,但氯气增多说明温度升高影响平衡逆向进行;
③可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(3)①反应前后气体体积减小,生成氯化氢越多,氯气转化率越大;
②C点HCl和Cl2浓度相同,结合三行计算列式得到平衡状态下物质的物质的量,分压=总压×物质的量分数,Kp是平衡分压代替平衡浓度计算;
解答 解:(1)①氮原子与氢原子、氯原子之间形成1对共用电子对,电子式为 ,
,
故答案为: ;
;
②NH3(g)+Cl2(g)=NH2Cl(l)+HCl(g),△H=反应物的键能之和-生成物的键能之和=(3×391.3+243.0)-(2×391.3+191.2+431.8)=+11.3 kJ•mol-1,
故答案为:+11.3 kJ/mol;
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为NH2Cl+H2O?NH3+HClO,
故答案为:NH2Cl+H2O?NH3+HClO;
(2)①6.25×10-8mol•L-1•min-1;
②根据数据,在400℃时,甲容器,平衡后0.8mol,乙容器中1.00mol,达到平衡时间短说明反应速率大,乙中剩余氯气应少,但氯气增多说明温度升高影响平衡逆向进行,逆向为吸热反应,正向为放热反应,△H<0,温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小,
故答案为:<; 温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小;
③2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),
A.反应前后气体质量变化,气体体积不变,若容器内气体密度不变,则表明反应达到平衡状态,故A正确;
B.向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2mol C12和2mol NH3,若容器内C12和NH3物质的量之比不变,说明此时物质浓度不变,则表明反应达到平衡状态,故B正确;
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,总压增大分压不变,平衡不变,Cl2的转化率不变,故C错误;
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,为液体不影响此平衡的移动,故D错误;
故答案为:AB;
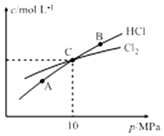
(3)①2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),反应前后气体体积减小,气体压强减小,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,三点中B点HCl最多,则B点氯气转化率最大,
故答案为:B;
②设反应氨气物质的量x,
2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),
起始量(mol) 2 1 0 0
变化量(mol) 2x x x 2x
平衡量(mol)2-2x 1-x x 2x
2-2x=2x
x=0.5mol,
总物质的量=3-3x+2x=3-x=2.5mol,总压强为10MPa
平衡分压代替平衡浓度计算C点时该反应的压强平衡常数Kp(C)=$\frac{{P}^{2}(HCl)}{{p}^{2}(C{l}_{2})p(N{H}_{3})}$=$\frac{(10×\frac{1}{2.5})^{2}}{(10×\frac{1}{2.5})^{2}×(10×\frac{0.5}{2.5})}$=0.5MPa,
故答案为:0.5MPa;
点评 本题考查了反应热的计算、化学平衡状态的判断、化学平衡移动以及化学平衡常数计算、化学方程式的书写等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | ClO-+H3O+?HClO+H2O | ||
| C. | HS-+H2O?H2S+OH- | D. | NH4++OH-?NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 +CH3COOH
+CH3COOH
 +H2O.
+H2O. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| B. | “人造太阳”原理为:21H+31H→42He+10n,该过程不是化学变化 | |
| C. | “84”消毒液的有效成分是Ca(ClO)2 | |
| D. | 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 标准状况下,22.4 L Cl2与水反应转移的电子数为NA | |
| C. | 50℃下,1L pH=2的稀硫酸溶液中含有的H+数目为0.01NA | |
| D. | 30 g乙酸和乙酸乙酯的混合物中含有的碳原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较和相同体积、浓度均为0.1mol•L-1的HA和HCl所消耗0.1mol•L-1NaOH溶液的体积 | |
| B. | 比较浓度均为0.1mol•L-1的NaCl溶液和HA溶液的导电性 | |
| C. | 测量0.1mol•L-1NaA溶液的pH | |
| D. | 将pH为1的HA溶液稀释100倍后,再测溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com