
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
|
| c(CH3OH) |
| c(CO)c2(H2) |
| ||
| tBmin |
| 2nB |
| 3tB |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
|
|


科目:高中化学 来源: 题型:
| 足量CH3COOH |
| ① |
| O2 |
| NaOH溶液△ |
| ② |
| H+ |
| 浓硫酸 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 酚酞、NaOH混合溶液 | 溶液红色消失 | SO2具有漂白性 |
| B | NH3 | 酚酞试液 | 溶液变红 | NH3的水溶液显碱性 |
| C | X | 澄清石灰水 | 溶液变浑浊 | X一定是CO2 |
| D | Cl2 | 淀粉、KI混合溶液 | 溶液变蓝色 | Cl2有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24 L HF含有的电子数为NA |
| B、7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA |
| C、常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| D、电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与NaOH反应的氯气一定为0.25 mol |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、若反应中转移的电子为n mol,则0.30<n<0.45 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.
将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
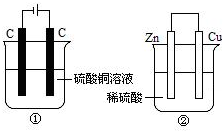 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com