

(1)若以A点表示
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)和c(Bn-)表示离子的物质的量浓度。在某温度下Ca(OH)2的溶解度为
科目:高中化学 来源:2010年湖北省高二12月月考化学试卷 题型:填空题
设水的电离平衡线如下图所示。
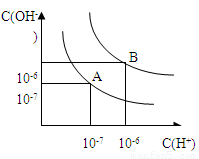
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________ 。
查看答案和解析>>
科目:高中化学 来源:0106 期中题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
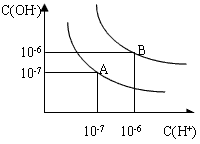
设水的电离平衡线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设水的电离平衡线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com