
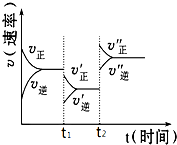
 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、物质的量就是物质的质量 | ||||
| B、摩尔是表示物质质量的单位 | ||||
| C、水的摩尔质量就是它的相对分子质量 | ||||
D、在相同温度和压强下,2H2+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4═H2++SO42- |
| B、Ba(OH)2═Ba2++2OH- |
| C、NaNO3═Na++N5++O32- |
| D、K2CO3═K++CO3-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
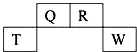 如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A、气态氢化物稳定性:R>Q |
| B、Q与W可形成直线型分子QW2 |
| C、同主族气态氢化物中R的氢化物最稳定,因其分子间存在氢键 |
| D、原子半径:T>W,简单离子半径:T<W |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-40℃NH4F-100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 | 33.3 | 37.2 | 41.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol?L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向500mL 1 mol/LNa2CO3溶液中,滴加600mL 1 mol/LHCl 得到标况下CO2体积为2.24L |
| B、电解精炼铜时,若阴极得到2摩尔电子,则阳极质量减少64克 |
| C、将208 g BaCl2固体溶解在1 L水中,形成的溶液的浓度为1 mol?L-1 |
| D、可用pH试纸测得氯水的酸性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com