
| A. | 元素电负性越大的原子,吸引电子的能力越强 | |
| B. | 在NH4+ 和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 在晶体钋(简单立方堆积)中,每个钋原子周围紧密相邻的钋原子有8个 | |
| D. | CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为配位键 |
分析 A.根据电负性的概念分析,电负性越大,该元素的原子吸引电子的能力越强;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键;
C.简单立方堆积的金属晶体中,每个顶点有一个金属原子;
D.含有空轨道和孤电子对的原子之间易形成配位键.
解答 解:A.元素电负性是表示对键合电子的吸引力的大小,电负性越大对键合电子吸引力越大,故A正确;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键,故B正确;
C.简单立方堆积的金属晶体中,每个顶点有一个金属原子,从三维坐标分析,每个坐标轴上2个金属原子,共6个原子,所以每个钋原子周围紧密相邻的钋原子有6个,故C错误;
D.Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,镍原子中含有空轨道,CO与N2结构相似,含有C≡O键,CO中含有孤电子对,所以二者能形成配位键,故D正确;
故选C.
点评 本题考查元素电负性、配位键、晶体结构,明确配位键的形成条件是解本题关键,难点是C配位数的计算,题目难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中含有的化学键数为7NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 1mol OH- 和1 mol-OH(羟基)中含有的质子数均为9NA | |
| D. | 10L 0.1 mol•L-1 的Na2CO3溶液中,Na+、CO32- 总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O2 CO2 | ||
| C. | CaCl2 NaOH H2O | D. | C2H6 H2O2 C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化氢在氧气中燃烧 | B. | 二氧化硫通入石灰水中 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 硫酸中加入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入少量C,正反应速率增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入CO,混合气体的密度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青苹果中只含淀粉不含糖类 | B. | 熟苹果中只含糖类不含淀粉 | ||
| C. | 苹果转熟时淀粉水解产生有葡萄糖 | D. | 苹果转熟时葡萄糖聚合成淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O?NH4++OH- | B. | H2SO3?2H++SO32- | ||
| C. | Fe(OH)3?Fe3++3OH- | D. | H2SO4→2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
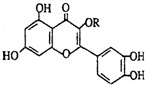 )存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A. | 1mol维生素P最多可以和5mol溴水发生加成反应 | |
| B. | 可溶于有机溶剂 | |
| C. | 分子中有三个苯环 | |
| D. | 1mol维生素P最多可以和4molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com