
| A. | 0.25(b-2a)mol/L | B. | 4(2a-b)mol/L | C. | 2(b-2a)mol/L | D. | 4(b-2a)mol/L |
分析 混合溶液分成两等份,每份溶液浓度相同,一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),再利用电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度相同.一份加入含a mol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4)=amol,
另一份加入含bmol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=bmol,
根据电荷守恒可知每份中2n(Ba2+)+n(K+)=n(Cl-),每份溶液中n(K+)=bmol-2amol=(b-2a)mol,
故钾离子浓度为:c(K+)=$\frac{(b-2a)mol}{0.25L}$=4(b-2a) mol•L-1,
故选D.
点评 本题考查离子反应的计算、混合物反应的计算,为高频考点,题目难度中等,明确发生的反应及物质的量关系为解答的关键,侧重分析、计算能力的考查,注意每份中离子浓度相同.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
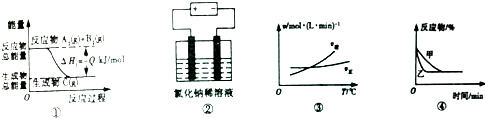
| A. | 图①表示可逆反应A2(g)+B2(g)?C(g)的△H1大于0 | |
| B. | 图②是电解氯化钠稀溶液的电解池,其中阴、阳极产生气体的体积之比一定为1:1 | |
| C. | 图③表示可逆反应A2(g)+3B2(g)?2AB3(g)的△H小于0 | |
| D. | 图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能储存起来 | |
| C. | 吸热反应都要加热才能进行 | |
| D. | 物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
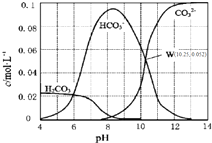 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 向Na2CO3溶液中通入HCl气体,立即产生CO2气体 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成CO2气体224 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Na+)+n(H+)=n(HCO3-)+n(CO32-)+n(OH-) | |
| B. | 通入CO2,平衡向正反应方向移动 | |
| C. | 加入少量的NaOH固体,平衡向逆反应方向移动,溶液pH减小 | |
| D. | 稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com