
| A、四种元素的原子半径:A<B<C<D |
| B、四种元素A、B、C、D的氧化物都不止一种 |
| C、由B与A组成的化合物的沸点一定低于由C与A组成的化合物的沸点 |
| D、CaA2、CaB2这两种化合物中,阳离子与阴离子个数比均为1:2 |


科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=+817.63 kJ?mol-1 |
| B、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ?mol-1 |
| C、N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=+641.63 kJ?mol-1 |
| D、N2H4(g)+2H2O2(l)═N2(g)+4H2O (g)△H=-817.63 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
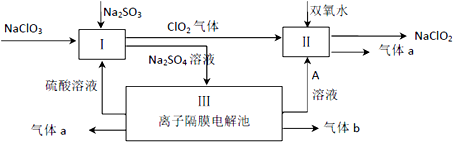
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成纤维和光导纤维都是新型无机非金属材料 |
| B、乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 |
| C、淀粉、纤维素的化学式都可表示为(C6H10O5)n,二者互为同分异构体 |
| D、乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均只有一种 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请回答下列问题.
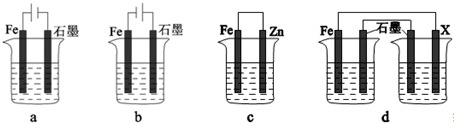
请回答下列问题.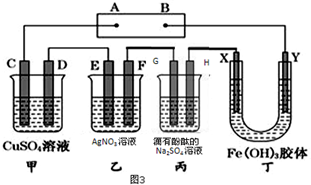
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4L CO2中含有NA个CO2分子 |
| B、17.6g丙烷中所含的极性共价键为4NA个 |
| C、1.7g H2O2中含有的电子数为0.9NA |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、向Fe2O3溶液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
| D、MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com