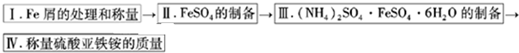
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2 向处理过的铁屑中加入过量的3mol?L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有______(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是______;
(3)在步骤3中,“一系列操作”依次为______、______和过滤;
(4)本实验制的硫酸亚铁铵晶体常含有Fe3+杂质.检验Fe3+常用的试剂是______,可以观察到得现象是______.
【答案】分析:(1)步骤1是溶液的加热和过滤,结合加热与过滤基本操作选择仪器.
(2)亚铁离子在加热过程中会发生水解.
(3)步骤3是由溶液中获得晶体,是抑制亚铁离子的水解下的蒸发与结晶过程.
(4)检验Fe3+常用的试剂是KSCN溶液等,Fe3+与KSCN溶液反应,溶液显血红色,说明含有Fe3+.
解答:解:(1)步骤1是溶液的加热和过滤,需要的仪器有:铁架台、锥形瓶、玻璃棒、酒精灯,故不需要燃烧匙、广口瓶、研钵.
故选:②④⑤.
(2)亚铁离子在加热过程中会发生水解,因而要加酸抑制亚铁离子的水解,故所加的硫酸必须过量.
故答案为:加酸抑制亚铁离子的水解.
(3)步骤3是由溶液中获得晶体,亚铁离子在加热过程中会发生水解,应在抑制亚铁离子的水解情况下,加热浓缩、冷却结晶、过滤、洗涤等.
故答案为:加热浓缩、冷却结晶.
(4)检验Fe3+常用的试剂是KSCN溶液等,将晶体配成溶液,向溶液中滴入KSCN溶液,溶液显血红色,说明含有Fe3+.
故答案为:KSCN溶液;溶液显血红色.
点评:考查溶液的加热、过滤、固体溶解、蒸发(防水解)、结晶等一系列实验基本操作、离子检验等,难度不大,是对所学知识的综合运用,注意基础知识的掌握.