
| A. | ①②⑤ | B. | ②③④ | C. | ②③⑥ | D. | 全部 |
科目:高中化学 来源: 题型:解答题
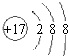
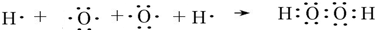
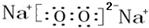 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 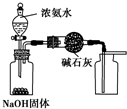 用图所示装置制取干燥纯净的氨气 | |
| B. | 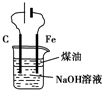 用图所示装置制备并观察氢氧化亚铁的颜色 | |
| C. | 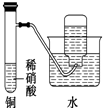 为制备并收集少量NO2气体 | |
| D. |  量取0.10 mol•L-1KOH溶液20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子半径为d>c>b>a | |
| B. | b,d元素形成的最高价氧化物对应的水化物的酸性b>d | |
| C. | c与其它3种元素均能形成离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可能为酸性、也可能为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
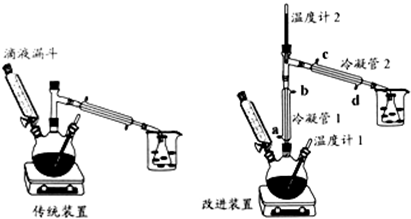
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
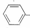 一R能被酸性 KMn04溶液氧化生成
一R能被酸性 KMn04溶液氧化生成 一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为
一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为 一C00H 的同分异构体数目为( )
一C00H 的同分异构体数目为( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com