

分析 电解A溶液生成三种物质,且D为金属且常呈红棕色,则D为Cu,A为氧酸的铜盐,在阴极生成金属,则阳极应生成O2,其中E可在B中燃烧说明B为O2,C为含氧酸,B与金属E反应得到F是一种黑色晶体,F为氧化物,F与酸反应后生成两种盐,说明金属为变价金属,则E应为Fe,则C为H2SO4,不可能为硝酸,否则四氧化三铁与硝酸反应只生成一种物质,故F为Fe3O4,G为FeSO4,H为Fe2(SO4)3,A应为CuSO4,据此解答.
解答 解:电解A溶液生成三种物质,且D为金属且常呈红棕色,则D为Cu,A为氧酸的铜盐,在阴极生成金属,则阳极应生成O2,其中E可在B中燃烧说明B为O2,C为含氧酸,B与金属E反应得到F是一种黑色晶体,F为氧化物,F与酸反应后生成两种盐,说明金属为变价金属,则E应为Fe,则C为H2SO4,不可能为硝酸,否则四氧化三铁与硝酸反应只生成一种物质,故F为Fe3O4,G为FeSO4,H为Fe2(SO4)3,A应为CuSO4.
(1)已知1g Fe在氧气中燃烧放出的热量为Q kJ,表示Fe燃烧热的热化学方程式为:Fe(s)+$\frac{2}{3}$O2(g)=$\frac{1}{3}$Fe3O4(s)△H=-56Q kJ/mol,
故答案为:Fe(s)+$\frac{2}{3}$O2(g)=$\frac{1}{3}$Fe3O4(s)△H=-56Q kJ/mol;
(2)Fe2+具有还原性,可与酸性高锰酸钾溶液发生氧化还原反应,可用高锰酸钾检验,由于铁离子存在,用氯水和KSCN溶液、氢氧化钠溶液无法检验亚铁离子,
故答案为:C;
(3)用惰性电极电解一定浓度的CuSO4的水溶液,电解时,在阴极生成金属,则阳极应生成O2,阳极反应式为:4OH--4e-=2H2O+O2↑,
电一段时间后,向所得溶液中加入8.0g CuO后恰好恢复到电解前的浓度和pH,而电解过程相当于析出CuO,故生成氧气为$\frac{1}{2}$×$\frac{8g}{80g/mol}$=0.05mol,则电解过程中收集到标准状况下的气体体积为0.05mol×22.4L/mol=1.12L,
故答案为:4OH--4e-=2H2O+O2↑;1.12L.
点评 本题考查无机物的推断,根据D的颜色及电解产物的进行推断,需要学生熟练掌握元素化合物性质,需要学生具备扎实的基础,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 6A% | B. | 10A% | C. | $\frac{A}{6}$% | D. | (100-$\frac{7A}{6}$)% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | B. | △H1>△H2 | C. | △H1=△H2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验目的 |
| A | 钠和镁分别投入冷水中 | 判断钠和镁的金属性强弱 |
| B | 在MgCl2和AlCl3溶液中分别加入过量的氨水 | 判断镁和铝的金属性强弱 |
| C | 向硅酸钠溶液中通入CO2 | 判断碳酸与硅酸的酸性强弱 |
| D | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳,静置 | 判断溴与碘的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
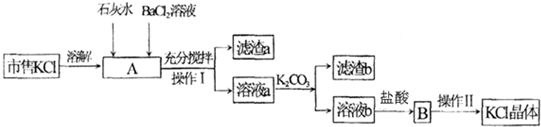
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com