
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
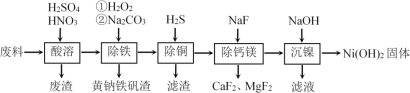
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成。写出金属镍溶解的离子方程式________________________。
(2)“除铁”时H2O2的作用是____________________,为了证明添加的H2O2已足量,应选择的试剂是____________________(填“铁氰化钾”或“硫氰化钾”)溶液。黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x∶y∶m∶n=1∶3∶2∶________。
(3)“除铜”时,反应的离子方程式为_________________________,若用Na2S或Na2S2O3代替H2S除铜,优点是__________________________。
(4)已知除杂过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是_______________________________。
(5)100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,则镍回收率的计算式为_______。
(6)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M+Ni(OH)2![]() HM+NiOOH(式中M为储氢合金)。写出电池放电过程中正极的电极反应式________。
HM+NiOOH(式中M为储氢合金)。写出电池放电过程中正极的电极反应式________。
【答案】5Ni + 12H+ + 2NO3 -= 5Ni2+ + N2↑ + 6H2O 将Fe2+氧化成Fe3+ 铁氰化钾 6 H2S + Cu2+ = CuS↓+ 2H+ 不易挥发污染性气体H2S 过量的F—在酸性条件下会腐蚀陶瓷容器 ![]() 100% NiOOH + H2O +e- = Ni(OH)2 + OH-
100% NiOOH + H2O +e- = Ni(OH)2 + OH-
【解析】
一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,加入硫酸和硝酸酸溶,合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成,过滤除去废渣,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠调节溶液pH除去铁离子,过滤得到滤渣和滤液,滤液中加入H2S沉淀铜离子,过滤得到滤液中加入NaF用来除去镁离子和钙离子,过滤得到滤液中主要是镍离子,加入氢氧化钠溶液沉淀镍离子生成氢氧化镍固体,
(1)镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平书写离子方程式;
(2)过氧化氢氧化亚铁离子为铁离子便于除去且不沉淀其他金属离子,利用铁氰化钾和亚铁离子结合生成蓝色溶液检验亚铁离子是否除净;由题给信息,黄钠铁矾[NaxFey(SO4)m(OH)n]元素化合价代数和为0;
(3)硫化氢和铜离子反应生成难溶于酸的硫化铜沉淀,硫化氢是剧毒气体分析;
(4)NaF的实际用量为理论用量的1.1倍,用量不宜过大是因为,过量氟化钠会在溶液中生成氟化氢,陶瓷容器中的二氧化硅会和氟化氢形成的酸溶液反应;
(5)废料含镍质量分数约21%,100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,依据镍元素守恒计算回收得到镍和原来镍的质量,计算回收率;
(6)正极上NiOOH得电子生成Ni(OH)2。
(1)镍和硝酸反应生成镍离子、氮气和水,结合电荷守恒、原子守恒、电子守恒配平书写离子方程式为:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O,
故答案为:5Ni+12H++2NO3-=5Ni2++N2↑+6H2O;
(2)“除铁”时H2O2的作用是过氧化氢氧化亚铁离子为铁离子便于除去且不沉淀其他金属离子,为了证明添加的H2O2已足量,应选择的试剂是利用铁氰化钾和亚铁离子结合生成蓝色溶液检验亚铁离子是否除净,由题给信息,将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去,黄钠铁矾[NaxFey(SO4)m(OH)n]中铁元素化合价为+3价,元素化合价代数和为0,x+3y-2m-n=0,得到x+3y=2m+n,x:y:m:n=1:3:2:p,则p=6,
故答案为:将亚铁离子氧化为铁离子;铁氰化钾;6;
(3)硫化氢和铜离子反应生成难溶于酸的硫化铜沉淀,反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,硫化氢是剧毒气体,若用Na2S或Na2S2O3代替H2S除铜,优点是无易挥发的有毒气体硫化氢污染环境,
故答案为:H2S+Cu2+=CuS↓+2H+;无易挥发的有毒气体硫化氢污染环境;
(4)NaF是强碱弱酸盐,氟化钠水解生成HF能腐蚀陶瓷容器,故用量不宜过大,
故答案为:过量的F-离子生成氢氟酸会腐蚀陶瓷容器;
(5)废料含镍质量分数约21%,100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,废料中镍元素质量=100kg×21%=21kg,反应生成镍元素质量=![]() 31kg,
31kg,
则镍回收率的计算式=![]() ×100%=
×100%= ![]() 100%,
100%,
故答案为:![]() 100%;
100%;
(6)NiMH电池放电过程中,正极上NiOOH得电子生成Ni(OH)2,根据得失电子守恒有NiOOH +e-= Ni(OH)2,根据电荷守恒利用OH-和H2O配平方程式,则正极的电极方程式为:NiOOH+H2O+e-= Ni(OH)2+OH-,
故答案为:NiOOH+H2O+e-= Ni(OH)2+OH-。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 64g SO2中含有的原子数为3NA
B. 5.6g金属铁变为离子时失去的电子数为0. 3NA
C. 常温常压下,11.2L Cl2含有的分子数为0.5NA
D. 1mol/L NaOH溶液中Na+的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是
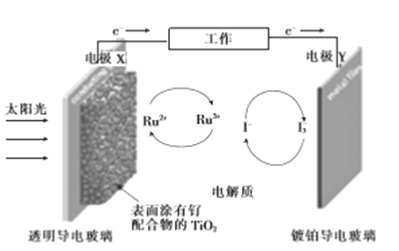
A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量 CO2 和 NaOH 溶液反应后的某溶液中逐滴滴入稀盐酸,开始阶段未产生 CO2气体,则该溶液中的溶质组成可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾在工业上具有广泛的应用,是焰火、照明弹等的主要成分。某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
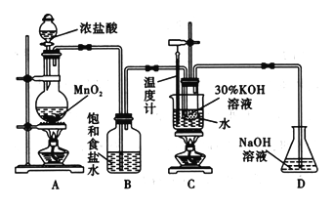
(1)写出装置A中发生反应的离子方程式:________________________________;写出装置C中发生反应的离子方程式:________________________________________。
(2)若无B装置,则装置C中氯酸钾的产率将________(填“提高” “降低”或“无影响”)。
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
蒸馏水 | 9.0 | V3 | 3.0 | 0 |
实验现象 |
①实验设计表中V1=____________; V3 =_______________。
②设计1号试管实验的作用是_________________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色。假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_____________________________。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂ClO2,该反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中:(填序号)
(1)互为同分异构体的有________(2)互为同素异形体的有_______
(3)属于同位素的有________(4)属于同一种物质的有______。
①液氨、②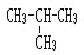 、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥
、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥![]() Cl、⑦
Cl、⑦![]() Cl、⑧C70、⑨氨气。
Cl、⑧C70、⑨氨气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 将少量![]() 通入
通入![]() 溶液中:
溶液中:![]()
B. 向稀氨水中通入少量![]() :
:![]()
C. 用稀![]() 溶解FeS固体:
溶解FeS固体:![]()
D. 将醋酸滴入硅酸钠溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com